Antibiotic Stewardship (ABS): rationale Antibiotikaverordnung sicherstellen
Zusammenfassung
Um die Antibiotika-Resistenzproblematik und Therapieversagen zu minimieren, sind rationale Antibiotikaverordnungsstrategien sowohl für den Krankenhausbereich als auch im ambulanten Sektor notwendig – auch in Deutschland. Voraussetzung hierfür ist die Verfügbarkeit von Verbrauchs- und Resistenzdaten, von Infrastruktur und Fachpersonal sowie von versorgungswissenschaftlichen Projekten, mit denen Forschungsergebnisse und Surveillance-Daten in Strategien und Bewertungen sowohl auf lokaler und regionaler als auch nationaler Ebene umgesetzt werden können. Ein Problem vor allem im Klinikbereich ist der Mangel an geschultem Personal, aber auch in anderen Bereichen hat Deutschland Nachholbedarf. Initiativen und Projekte, die teilweise im Rahmen der Deutschen Antibiotika-Resistenzstrategie gefördert wurden, haben hier bereits zu bescheidenen Erfolgen geführt. Insbesondere zu nennen sind GERMAP – ein Antibiotikaverbrauchs- und -resistenzatlas aus dem Human- und Veterinärbereich, bessere Datentransparenz im Bereich Antibiotikaverbrauchssurveillance, die so genannte ABS-Fortbildungsinitiative mit ABS-Experten-Netzwerk und die Bemühungen um mehr Fachpersonal vor allem in der klinischen Infektiologie. Dieser Artikel ist eine kurze Zusammenfassung der Hintergründe und möglicher Maßnahmen im Bereich rationale Antibiotikaverordnung durch Ärzte in Deutschland.
Abstract
To minimize the problem of antibiotic resistance and therapeutic failure rational strategies for high quality utilisation of antibiotics are urgently needed both in hospitals and in the outpatient sector – like in the most countries also in Germany. This requires the availability of data regarding prescription and consumption of antibiotics as well as resistance data and utility projects. Infrastructure and personnel have to be provided, which translate research results and surveillance data into evaluations and strategies at local, regional and national levels. A major problem especially in the hospitals is the lack of appropriately trained staff. Initiatives and projects – partially funded under the German Antibiotic Resistance Strategy – led to modest improvement. To mention, in particular, are GERMAP – an antibiotic consumption and resistance map from the human and veterinary medicine, better data transparency in the field of antibiotic utilisation surveillance, the so-called ABS training initiative with ABS expert network and efforts to provide more specialised personnel in clinical infectiology. This article is a short summary of background and possible measures in the area of rational prescription of antibiotics through doctors in Germany.
Hintergrund: mehr Infektionen, intensiver Antibiotikaeinsatz, mehr Antibiotikaresistenz, weniger neue Substanzen
Mehr Infektionen im Zusammenhang mit der demographischen Entwicklung und auch dem medizinischen Fortschritt haben in vielen Regionen zu einem erheblichen Anstieg der Antibiotikaverordnungen geführt, oft mit einer Betonung der empirischen Behandlung mit sehr breit wirksamen Substanzen (1). Hinzu kommen teilweise erhebliche Mengen von Antibiotika, die in der Veterinärmedizin und Lebensmittelproduktion eingesetzt werden, darunter viele Substanzen, die auch in der Humanmedizin gebraucht werden (2;3). Die damit in Gang gesetzte nahezu unvermeidliche Resistenzentwicklung wird durch Effekte im Rahmen der Globalisierung noch amplifiziert. Zugleich sind Neuentwicklungen von innovativen Antibiotika in den letzten 10–20 Jahren auf einem noch nie gekannten Tiefstand angekommen (4). Schreibt man diese Entwicklung fort – so der von Großbritannien in Auftrag gegebene sogenannte AMR-Report von Lord Jim O´Neill – ist der medizinische Fortschritt in der Onkologie, beim Organersatz und in der Transplantationsmedizin durch Antibiotikaresistenz bedingte Todesfälle massiv gefährdet (5).
Ein unterschätztes Problem ist, dass bestimmte Entwicklungen hin zu mehr Antibiotikaresistenz über einen sehr langen Zeitraum persistieren und möglicherweise irreversibel sein können. Beispiele sind die hochgradige Aminoglykosidresistenz bei Enterokokken und die Resistenz von E. coli gegenüber Streptomycin, Sulfonamid bzw. Cotrimoxazol. Basierend auf Untersuchungen in England wurden hier bei klinischen Isolaten keine Änderungen beobachtet, obwohl die Anwendung dieser Substanzen in der Humanmedizin über die letzten 30 Jahre sehr stark zurückgegangen ist, inzwischen zum Teil verschwindend gering ist, und von dieser Seite ein Selektionsdruck nicht mehr ausgehen kann (6). Die Gründe hierfür sind vielfältig. Die Genetik der Antibiotikaresistenz kann sehr komplex sein. Bei Vorliegen von verschiedenen Resistenzgenen auf einem Plasmid beispielsweise kann es durch Einsatz einer Substanz B zu einer übertragbaren Resistenz auch gegenüber A kommen. Die Selektion oder Koselektion kann außerhalb des humanmedizinischen Bereiches (z. B. Lebensmittelproduktion) erfolgen, durch Übertragung aus dem Lebensmittelbereich auf den Menschen jedoch für die Humanmedizin relevant werden. Restriktion und Mengenreduktion bestimmter Antibiotikaklassen in Teilbereichen des Gesamtsystems Humanmedizin, Veterinärbereich/Lebensmittelproduktion als Reaktion auf solche problematische Entwicklung bietet keine ausreichende Sicherheit hinsichtlich Minimierung der Resistenzproblematik. Andererseits scheinen sich bestimmte Antibiotika bzw. Antibiotikaklassen bezüglich des Risikos einer Resistenzentwicklung zu unterscheiden.
Damit allein ist schon der Bedarf an nachhaltigen, rationalen und intelligenten Antibiotikaverordnungsstrategien – auch mit dem Begriff „Antibiotic Stewardship“ (ABS) bezeichnet – gut begründbar (7). Hinzu kommen Befunde aus der Mikrobiomforschung, die u. a. eine Behandlung mit bestimmten Substanzen mehr als mit anderen über unterschiedliche Effekte auf das Mikrobiom mit Adipositas und Allergien in Verbindung bringt, und Probleme und Unsicherheiten in der adäquaten Infektionsbehandlung völlig unabhängig von der Resistenzproblematik. So sind zugelassene Dosierungen nicht immer optimale Dosierungen, und die Grenzwerte nach In-vitro-Testung („empfindlich“ versus „resistent“) sind keineswegs immer ausreichend validiert. Es ist heute unbestritten, dass es tatsächlich Reserven in der Optimierung der Antiinfektivaverordnungsqualität gibt, und auch eine Verbrauchsreduktion ohne Gefährdung des Patienten (und ohne wesentliche ökonomische Einbußen in der Lebensmittelproduktion) möglich ist (4;5).
Inadäquate Verordnungen in der Humanmedizin
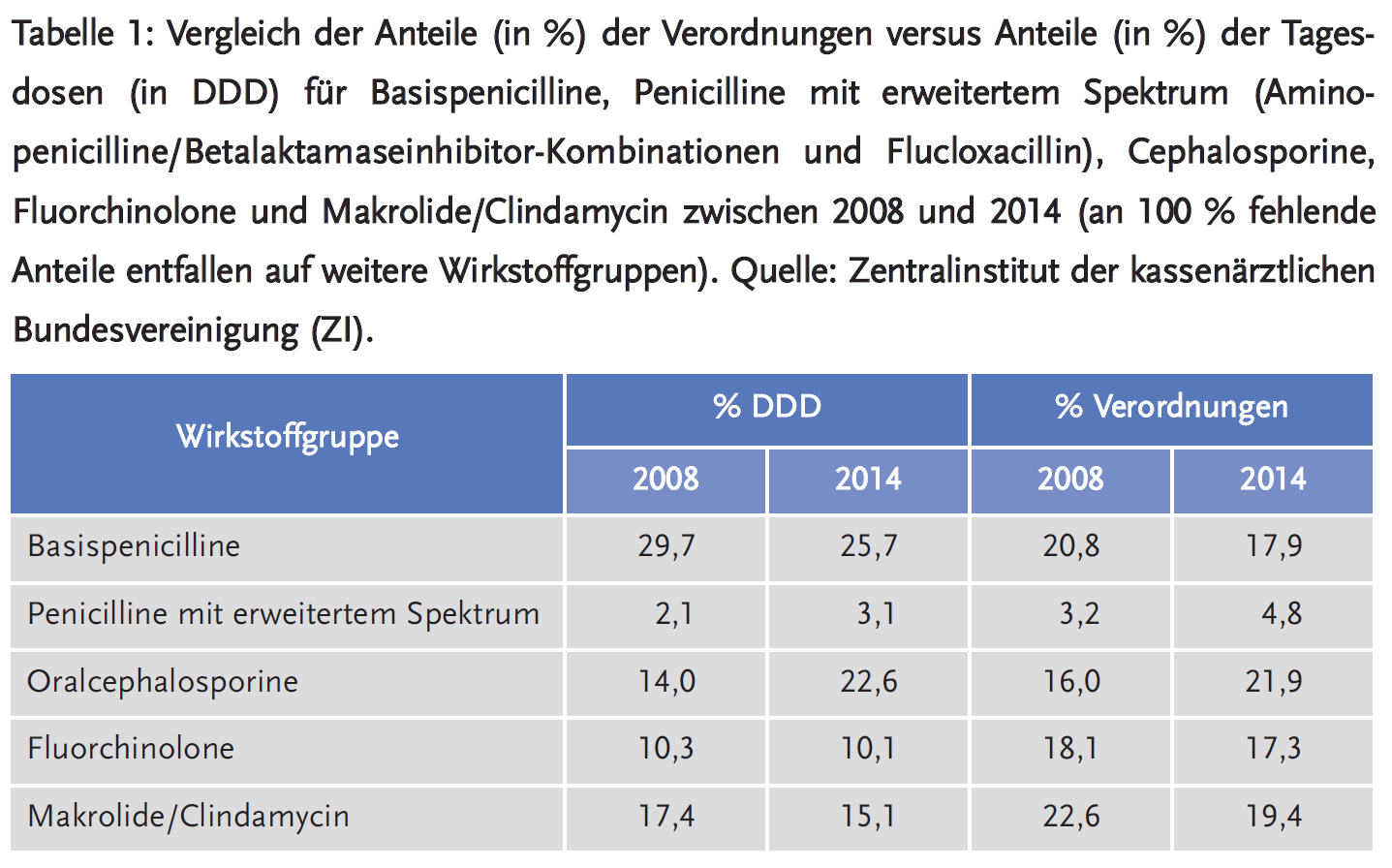
Wieviel Antibiotikatherapie kann man in der Humanmedizin einsparen? Wie hoch ist die Rate von inadäquaten Verordnungen, d. h. umstrittene Indikation, nicht empfohlene/falsche Substanz, falsche Dosis, inkorrekte Dauer? Die Schätzungen gehen hier weit auseinander – je nach Setting (Krankenhaus bzw. Krankenhausabteilung, ambulante Medizin je nach Facharztdisziplin) und Geographie – im Vergleich verschiedener Länder miteinander aber auch innerhalb eines Landes (8). Im ambulanten Bereich werden oft 30 % Einsparpotenzial genannt – vor allem bei Atemwegsinfektionen. Studien aus der Allgemeinmedizin haben gezeigt, dass es auch in Deutschland durchaus Einsparungspotenzial in der Antibiotikaverordnung in dieser Größenordnung gibt (9). Erfahrungen aus den Niederlanden – wo die ambulante Verordnungsdichte konsistent niedriger als in Deutschland ist – zeigen mit bestimmten Interventionen ein Reduktionspotenzial der Antiinfektivaverordnungen bei erwachsenen Patienten von rund zusätzlich 20 % (10). Innerhalb Deutschlands gibt es ebenfalls Unterschiede in der Rate von Antibiotikaverordnungen bei Atemwegsinfektionen in der Größenordnung von etwa 15 % (11), die nicht überzeugend durch Alters- und Morbiditätsunterschiede erklärt sind. Neben der speziell auch bei Atemwegsinfektionen (zu mehr als 90 % viral bedingt) geforderten kritischen Indikationsstellung und Therapiedauerbegrenzung spielt für die Qualität der Antibiotikaverordnung auch die Präferenz von Substanzen/Substanzklassen eine Rolle. In Deutschland beispielsweise gibt es seit Jahren eine ansteigende Präferenz von Oralcephalosporinen (siehe Tabelle 1) insbesondere bei Atemwegsinfektionen, wo sie aber gar nicht oder zumindest nicht als Erstlinientherapie empfohlen sind (12;13). Dies hat – nahezu einmalig in ganz Europa – dazu geführt, dass in Deutschland das Verhältnis zwischen Penicillinderivaten und Cephalosporinen ungewöhnlich verschoben ist zugunsten von Cephalosporinen (14). Ungewöhnlich deshalb, weil die wenigen bakteriellen Atemwegsinfektionen wie auch ambulant erworbene Pneumonien in erster Linie durch Pneumokokken verursacht werden und so in der Regel mit Amoxicillin besser behandelbar sind als mit dem beliebten Oral-Cephalosporin Cefuroximaxetil und anderen ähnlichen Substanzen.
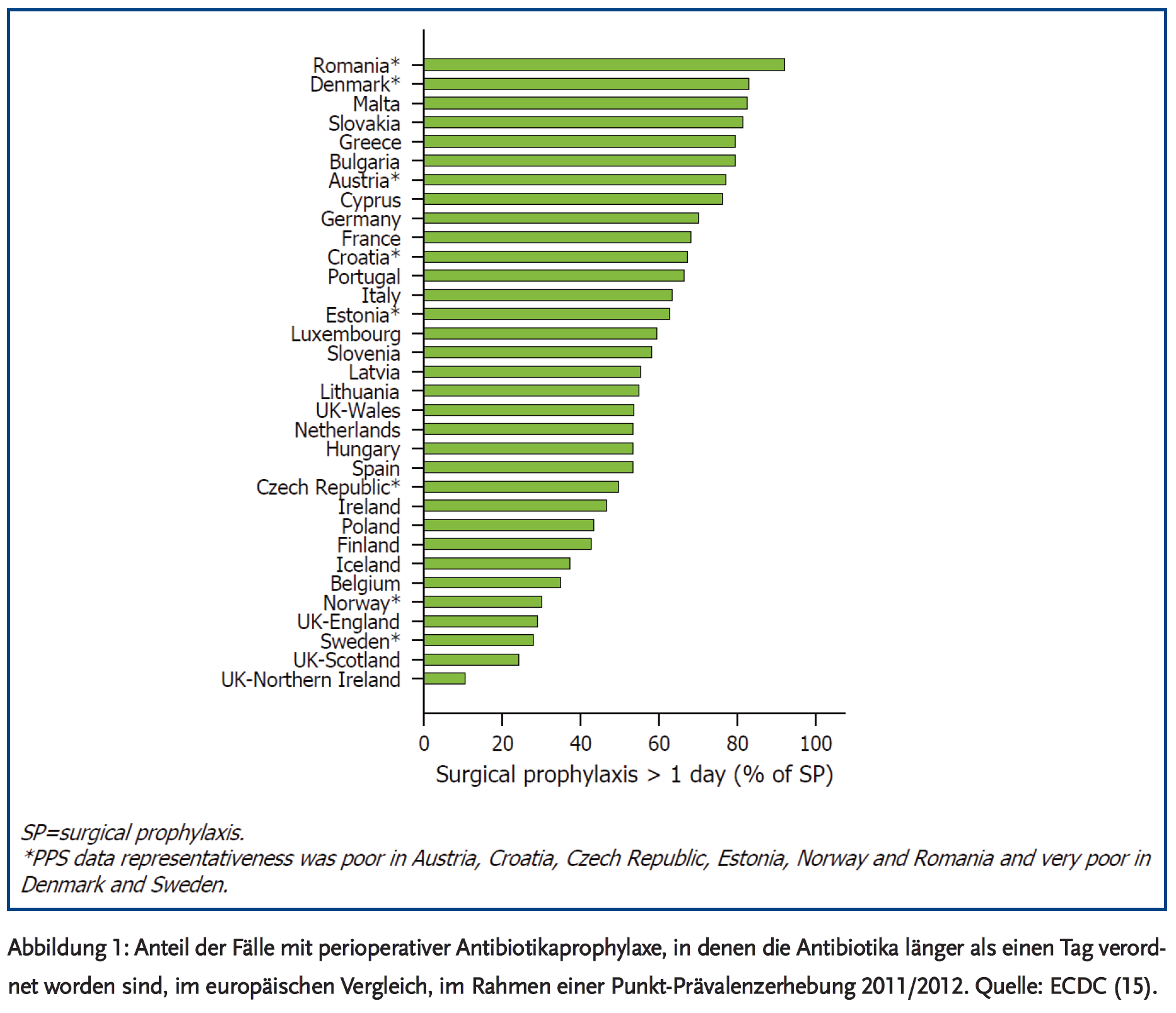
Für den stationären Sektor gibt es aus Deutschland sehr wenig kritische Prüfungen der Adäquatheit von Antibiotikatherapien. Bekannt ist die zu hohe, inadäquate Rate von > 24 Stunden hinaus verlängerter perioperativer Prophylaxe (15). Unseren Schätzungen zufolge würde alleine eine strikte Befolgung der Leitlinien in diesem Bereich eine Reduktion der Antibiotika-Gesamtverbrauchsdichte im Krankenhausbereich um etwa 10 % oder mehr (meistens Cephalosporine) bedeuten (Verbrauchsdichte ca. 50 % in operativen Fächern, davon ca. 30 % in der perioperativen Prophylaxe, davon wiederum können ca. zwei Drittel eingespart werden). Zahlreiche internationale interventionelle Studien in verschiedenen Krankenhausbereichen und bei unterschiedlichen Indikationen zeigen in der Gesamtschau ein Einsparpotenzial von rund 20–30 % – ohne Gefährdung der Behandlungsergebnisse und der Prognose des Patienten (16-19). Auch sind durch rein qualitative Änderungen der Verordnung im Krankenhausbereich ohne Änderung der Verbrauchsdichte bereits Effekte auf Resistenzentwicklung und Häufigkeit von Clostridium difficile-Infektion und Resistenzraten zu erzielen (intelligente Verordnung) (16-24). Meist geht es dabei um die Gruppe der so genannten 4C-Antibiotika (Cephalosprorine, Chinolone, Clindamycin/Clarithromycin, Co-Amoxiclav). Eine Reduktion von Cephalosporinen und Fluorchinolonen ohne Änderung im Gesamtverbrauch kann zu einer Reduktion der C. difficile-Infektionen um 50 % führen (16-18). Schaffen Infektiologen und/oder ABS-Teams darüber hinaus noch eine Reduktion des Gesamtverbrauchs, können die Effekte noch stärker sein. Zu betonen ist, dass die jüngeren versorgungswissenschaftlichen Untersuchungen in diesem Bereich zeigen konnten, dass dadurch die Prognose des Patienten nicht leidet (16).
Problemlösungen ambulant
Welche Maßnahmen in welchem Kontext tatsächlich eine wesentlich verbesserte Verordnungsqualität und eine Minimierung der Resistenzproblematik im ambulanten Bereich erzielen, ist nicht ganz klar. Vieles ist getestet worden, u. a.: Verwendung von CRP-Schnelltests und Schulungen hierfür, Kommunikationstraining (Arzt-Patienten-Interaktion) oder beides zusammen, einfache Antibiotika-Schulungen und Qualitätszirkel, verzögerte Rezepteinlösung als Strategie, Schulung und Feedback zusammen mit einem Qualitätssystem als Teil der Praxisakkreditierung, Feedback zu Verordnungshäufigkeiten (Mengen, nicht Kosten; benchmarking), schriftliche Begründung der Indikation in einem Online-System plus Verbrauchsfeedback, Verbrauchsfeedback speziell für Intensivverschreiber, an Patienten adressierte Plakate in der Praxis mit Erklärung zur Verantwortlichkeit des Praxisinhabers für einen kritischen rationalen Antibiotikaeinsatz, Kampagnen adressiert an die Patienten/Öffentlichkeit mittels Fernsehspots. Oft sind es Kombinationen von Maßnahmen, die die besseren Effekte erzielt haben. Daten zur Effektivität in deutschen Praxen sind jedoch rar. Die Methodik der Interventionen und auch die Ergebnisse aus Studien in anderen Ländern sind nicht einfach auf das deutsche Gesundheitssystem übertragbar (25). Die Nachhaltigkeit der verschiedenen Interventionen ist ebenfalls schwer beurteilbar – vor allem allgemeine Kampagnen (Plakate, TV-Spots etc.) sind, wenn überhaupt, nur sehr kurzzeitig wirksam (26). Als nachhaltige Maßnahme plausibel erscheint am ehesten eine Identifizierung von Hochverschreiberpraxen bzw. Verordnern von nicht leitlinienkonformen Antibiotika mittel Qualitätsindikatoren und entsprechende Angebote von (Pflicht-(?)) Schulungen in allgemeinen Fragen der Antibiotikabehandlung, CRP-Anwendung, Arzt-Patienten-Kommunikation etc. Ein Verschreibungsmengenfeedback an Hochverordner alleine war in Großbritannien nicht sehr effektiv (27).
Problemlösungen stationär
Im Klinikbereich sind es in der Regel strukturelle Defizite, die eine Qualitätsverbesserung der Antibiotikaverordnung behindern. Die Instrumente und Maßnahmen für erfolgreiches ABS im Akutkrankenhaus sind in Leitlinien und Empfehlungen wiederholt beschrieben und begründet worden (28-32). Der Blick zu Vergleichszwecken in die internationale Literatur sowie Umfragen bestätigen, dass es in erster Linie an Fachpersonal fehlt und es in den Kliniken für den Bereich rationale Antiinfektivaverordnung außerhalb der Arzneimittelkommissionen keine übergeordnete Verantwortlichkeiten gibt (33-35). Es sind sehr wenig infektiologische Fachabteilungen in Deutschland eingerichtet, die dann auch Weiterbildungsfunktionen und -kapazität haben. Die Dichte an Fachärzten für Infektiologie bzw. Ärzten mit der entsprechenden Zusatzweiterbildung, die Patienten mit komplexen Infektionen betreuen oder als Konsiliarärzte mitbetreuen und bezüglich ABS strategisch tätig sein können (36;37), liegt im europäischen und internationalen Vergleich im unteren Viertel. ABS wird oft mit Krankenhaushygiene gleichgesetzt, obwohl dafür sehr unterschiedliche Kompetenzen und Expertise gebraucht werden. ABS-Programme brauchen moderne EDV-Unterstützung für die Verordnungs- und Erregerstatistiken und ggf. elektronische Verordnungshilfen. Sie benötigen eine gute Kooperation mit der Klinikapotheke ebenso wie mit der medizinischen Mikrobiologie und Krankenhaushygiene. Die meisten Kliniken in Deutschland werden allerdings von externen Laboratorien mit mikrobiologischen Laborleistungen und oft auch mit krankenhaushygienischen Dienstleistungen versorgt. Zudem sind Mikrobiologie als auch Krankenhaushygiene keine patientennahen klinischen Disziplinen. Eine solche klinische Expertise und Erfahrung am Krankenbett werden jedoch bei Therapieentscheidungen dringend benötigt.

Es existieren kaum klinikweite spezialisierte Kommissionen oder multidisziplinäre Arbeitsgruppen mit Fachärzten und Fachapothekern (wie in Belgien und den Niederlanden in allen Krankenhäusern inzwischen verfügbar) oder zumindest mit speziell zu ABS fortgebildetem Personal, die im Bereich Antiinfektivaverordnung spezifisch Verantwortung übernehmen könnten und hierfür einen Auftrag (Mandat), Personalfreistellung (Deputat) und sonstige Ressourcen seitens der Klinikleitung erhalten. Defizite gibt es auch noch bei der Datengrundlage für ABS-Entscheidungen. Beispielsweise verfügen die meisten Kliniken in Deutschland nicht über regelmäßige Antiinfektivaverbrauchsdaten im Format Tagesdosen pro Pflegetage. Zwar ist die Verfügbarkeit von mikrobiologischen Daten besser, erreicht aber selbst in größeren Akutkliniken keinesfalls mehr als 80 %, und Standards für eine zeitnahe zuverlässige Erreger- und Resistenzstatistik sind nicht definiert (38).
Die deutsch-österreichische Leitlinie zu ABS im Krankenhaus hat entsprechende Empfehlungen sowohl zu Struktur und Voraussetzungen als auch zu den ABS-Aktivitäten formuliert, die weitgehend den bereits verfügbaren Leitlinien zu diesem Thema folgen (30;39). Aufgrund der personellen Defizite ist in Deutschland (wie auch in anderen Ländern) als Interimslösung in eine Schulung mittels Intensivkursen von Ärzten und Apothekern zu ABS im Krankenhaus investiert worden (33;34). Das Kursprogramm besteht aus vier Wochenkursen („ABS Basics“, „ABS Fellow“, „ABS Advanced“, „ABS Expert“), wobei die Teilnehmer zwischen den Kursteilen „ABS Advanced“ und „ABS Expert“ zusätzlich ein Praktikum zur Entwicklung, Einführung und Umsetzung erster ABS-Maßnahmen im eigenen Krankenhaus absolvieren, deren Ergebnisse im abschließenden ABS-Expert-Kurs durch die Teilnehmer vorgestellt und diskutiert werden. Das Fortbildungsprogramm umfasst damit insgesamt rund 160 Präsenzstunden plus 40 Praktikumsstunden. Das Abschlusszertifikat „ABS-Experte“ ist an die erfolgreiche Teilnahme der drei Aufbaukurse „ABS Fellow“, „ABS Advanced“ und „ABS Expert“ gebunden. Die Kursgröße beträgt 30 Teilnehmer, wobei sich die Teilnehmer aus überwiegend klinisch tätigen Fachärzten (Innere Medizin, internistische Intensivmedizin, Anästhesiologie u. a.) und Medizinischen Mikrobiologen sowie aus Krankenhausapothekern zusammensetzen. Die enorme Nachfrage der 2010 bis Anfang 2014 vom Bundesministerium für Gesundheit geförderten Fortbildungsinitiative und das ausgesprochen positive Feedback zeigen den großen Bedarf für derartige, industrieunabhängige Fortbildungen deutlich auf. Es sind inzwischen mehr als 500 solcher ABS-Experten zertifiziert worden, die sich im so genannten ABS-Expertennetzwerk austauschen. Der Bedarf liegt bei etwa 1000 solcher ABS-Experten – neben weiteren rund 1000 Stellen für Infektiologen – vor allem an größeren Kliniken. Die Kommission Antibiotikatherapie & -resistenz (ART-Ko) beim RKI plant nun eine Stellungnahme zu strukturellen und personellen Voraussetzungen für die Sicherung einer rationalen Antiinfektivaverordnung in Krankenhäusern, die viele der obigen Überlegungen und Erfahrungen als nationale Empfehlung – ähnlich den Empfehlungen zur Strukturierung der Krankenhaushygiene – zusammenfasst.
Fazit für die Praxis
Der Antibiotikaverbrauch in der Humanmedizin kann ohne Gefährdung für Patienten und mit Erfolg im Sinne einer Resistenzminimierung reduziert werden. Ambulante und stationäre Medizin brauchen hierfür unterschiedliche Interventionen. Beiden gemeinsam ist jedoch der Bedarf an mehr Schulung und Fortbildung bzw. fachärztlichem Personal. Versorgungswissenschaftliche Studien und Projekte sind enorm wichtig geworden, um Interventionen und Interventionsbündel mit konsistenten Effekten auf die Resistenzminimierung zu beschreiben und weiterzuentwickeln. Durch die Dynamik bei der epidemiologischen Entwicklung von Infektionserregern – antibiotikaempfindlichen wie auch -resistenten – braucht es eine kontinuierliche professionelle Surveillance auf verschiedenen Ebenen, um den oft entstehenden Anpassungsbedarf in Interventionen zu entdecken. Bei allen Bemühungen um Resistenzminimierung darf der Blick auf klinische Endpunkte bei der Sicherung einer rationalen Antibiotikaverordnung niemals vernachlässigt werden, ebenso relevant sind der Kontext der Antibiotikaanwendung in der Lebensmittelproduktion und Veterinärmedizin sowie der Erregerausbreitung im Rahmen der Globalisierung.
Interessenkonflikte
Ein Interessenkonflikt wird vom Autor verneint.
Literatur
- van Boeckel TP, Gandra S, Ashok A et al.: Global antibiotic consumption 2000 to 2010: an analysis of national pharmaceutical sales data. Lancet Infect Dis 2014; 14: 742-750.
- ECDC/EFSA/EMA first joint report on the integrated analysis of the consumption of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from humans and food-producing animals. EFSA Journal 2015; 13: 4006.
- Lhermie G, Gröhn YT, Raboisson D: Addressing antimicrobial resistance: an overview of priority actions to prevent suboptimal antimicrobial use in food-animal production. Front Microbiol 2017; 7: 2114.
- Laxminarayan R, Duse A, Wattal C et al.: Antibiotic resistance – the need for global solutions. Lancet Infect Dis 2013; 13: 1057-1098.
- O’Neill J (Hrsg.): Review on Antimicrobial Resistance: Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations:https://amr-review.org/sites/default/files/AMR%20Review%20Paper%20-%20Tackling%20a%20crisis%20for%20the%20health%20and%20wealth%20of%20nations_1.pdf
- Bean DC, Livermore DM, Papa I, Hall LM: Resistance among Escherichia coli to sulphonamides and other antimicrobials now little used in man. J Antimicrob Chemother 2015; 56: 962-964.
- MacDougall C, Polk RE: Antimicrobial stewardship programs in health care systems. Clin Microbiol Rev 2005; 18: 638-656.
- Marquet K, Liesenborgs A, Bergs J et al.: Incidence and outcome of inappropriate in-hospital empiric antibiotics for severe infection: a systematic review and meta-analysis. Crit Care 2015; 19: 63.
- Altiner A, Brockmann S, Sielk M et al.: Reducing antibiotic prescriptions for acute cough by motivating GPs to change their attitudes to communication and empowering patients: a cluster-randomized intervention study. J Antimicrob Chemother 2007; 60: 638-644.
- Vervloet M, Meulepas MA, Cals JW et al.: Reducing antibiotic prescriptions for respiratory tract infections in family practice: results of a cluster randomized controlled trial evaluating a multifaceted peer-group-based intervention. NPJ Prim Care Respir Med 2016; 26: 15083.
- Schulz M, Kern WV, Hering R et al.: Antibiotikaverordnungen in der ambulanten Versorgung in Deutschland bei bestimmten Infektionserkrankungen in 2009 – Teil 1 und 2:http://www.versorgungsatlas.de/themen/versorgungsprozesse/?tab=6&uid=46
- Bätzing-Feigenbaum J, Schulz M, Schulz M et al.: Outpatient antibiotic prescription. Dtsch Arztebl Int 2016; 113: 454-459.
- Kern WV, Schaufler J, Telschow C: Antibiotikaverbrauch im ambulanten Bereich, In: Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. (Hrsg.): GERMAP2015 – Antibiotika-Resistenz und -Verbrauch. Rheinbach: Antiinfectives Intelligence, 2016; 9-15.
- Kern WV, Schulz M, Mangiapane S.: Antibiotikaverschreibung im ambulanten Setting – welche Qualitätsindikatoren sind geeignet? In: Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, Paul-Ehrlich-Gesellschaft für Chemotherapie e.V., Infektiologie Freiburg (Hrsg.): GERMAP2012 – Antibiotika-Resistenz und -Verbrauch. Rheinbach: Antiinfectives Intelligence, 2014; 18-22.
- European Centre for Disease Prevention and Control (ECDC): Point prevalence survey of healthcare-associated infections and antimicrobial use in European acute care hospitals 2011-2012. Stockholm: ECDC; 2013.
- Davey P, Marwick CA, Scott CL et al.: Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database Syst Rev 2017; 2: CD003543.
- Akpan MR, Ahmad R, Shebl NA et al.: A review of quality measures for assessing the impact of antimicrobial stewardship programs in hospitals. Antibiotics (Basel) 2016; 5: e5.
- Karanika S, Paudel S, Grigoras C et al.: Systematic review and meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs. Antimicrob Agents Chemother 2016; 60: 4840-4852.
- Schuts EC, Hulscher ME, Mouton JW et al.: Current evidence on hospital antimicrobial stewardship objectives: a systematic review and meta-analysis. Lancet Infect Dis 2016; 16: 847-856.
- Dingle KE, Didelot X, Quan TP et al.: Effects of control interventions on Clostridium difficile infection in England: an observational study. Lancet Infect Dis 2017; 17: 411-421.
- DiDiodato G, McArthur L: Evaluating the effectiveness of an antimicrobial stewardship program on reducing the incidence rate of healthcare-associated Clostridium difficile infection: a non-randomized, stepped wedge, single-site, observational study. PLoS One 2016; 11: e0157671.
- Lawes T, López-Lozano JM, Nebot C et al.: Turning the tide or riding the waves? Impacts of antibiotic stewardship and infection control on MRSA strain dynamics in a Scottish region over 16 years: non-linear time series analysis. BMJ Open 2015; 5: e006596.
- Lawes T, Lopez-Lozano JM, Nebot CA et al.: Effects of national antibiotic stewardship and infection control strategies on hospital-associated and community-associated meticillin-resistant Staphylococcus aureus infections across a region of Scotland: a non-linear time-series study. Lancet Infect Dis 2015; 15: 1438-1449.
- Lawes T, Lopez-Lozano JM, Nebot CA et al.: Effect of a national 4C antibiotic stewardship intervention on the clinical and molecular epidemiology of Clostridium difficile infections in a region of Scotland: a non-linear time-series analysis. Lancet Infect Dis 2017; 17: 194-206.
- Böhmer F, Wollny A, Altiner A: Optimising prescribing for acute respiratory tract infections as an example for antimicrobial stewardship in primary care. In: Pulcini C, Ergonül O, Can F, Beovic B (Hrsg.): Antimicrobial Stewardship. London: Academic Press/Elsevier, 2017; 167-174.
- King S, Exley J, Taylor J et al.: Antimicrobial stewardship: the effectiveness of educational interventions to change risk-related behaviours in the general population: a systematic review. Rand Health Q 2016; 5: 2.
- Hallsworth M, Chadborn T, Sallis A et al.: Provision of social norm feedback to high prescribers of antibiotics in general practice: a pragmatic national randomised controlled trial. Lancet 2016; 387: 1743-1752.
- Barlam TF, Cosgrove SE, Abbo LM et al.: Implementing an antibiotic stewardship program: guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis 2016; 62: e51-77.
- National Institute for Health and Care Excellence (NICE). Antimicrobial stewardship: systems and processes for effective antimicrobial medicine use:http://www.nice.org.uk/guidance/ng15/evidence/full-guideline-74002861
- de With K, Allerberger F, Amann S et al.: Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaushttp://www.awmf.org/uploads/tx_szleitlinien/092-001l_S3_Antibiotika_Anwendung_im_Krankenhaus_2013-12.pdf
- Pollack LA, Plachouras D, Sinkowitz-Cochran R et al.: A concise set of structure and process indicators to assess and compare antimicrobial stewardship programs among EU and US hospitals: results from a multinational expert panel. Infect Control Hosp Epidemiol 2016; 37: 1201-1211.
- European Centre for Disease Prevention and Control (ECDC): Technical Report – Proposals for EU guidelines on the prudent use of antimicrobials in humans. Stockholm: ECDC; 2017.
- Kern WV, de With K: Rationale Antibiotikaverordnung. Bundesgesundheitsbl 2012; 55: 1418-1426.
- Kern WV: Fortbildungsinitiative Antibiotic Stewardship für Krankenhausärzte und-apotheker. Krankenhaushygiene up2date 2012; 7: 47-54.
- Kern WV, Fätkenheuer G, Tacconelli E, Ullmann A: [Infectious diseases as a clinical specialty in Germany and Europe]. Z Evid Fortbild Qual Gesundhwes 2015; 109: 493-499.
- Pulcini C, Botelho-Nevers E, Dyar OJ, Harbarth S: The impact of infectious disease specialists on antibiotic prescribing in hospitals. Clin Microbiol Infect 2014; 20: 963-972.
- Rieg S, Küpper MF: Infectious diseases consultations can make the difference: a brief review and a plea for more infectious diseases specialists in Germany. Infection 2016; 44: 159-166.
- de With K, Kern WV: Antimicrobial stewardship in Germany. In: Pulcini C, Ergonül O, Can F, Beovic B (Hrsg.): Antimicrobial Stewardship. London: Academic Press/Elsevier, 2017; 275-279.
- de With K, Wilke K, Först G et al.: Antibiotic Stewardship (ABS) in Akutkrankenhäusern – neue Erfahrungen und Empfehlungen. Dtsch Med Wochenschr 2017; 142: 177-182.
