Opicapon (Ongentys®) (frühe Nutzenbewertung)
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
In Kürze
- Mit Opicapon wurde ein weiterer COMT-Hemmer für die Indikation „Zusatztherapie zu Levodopa/DOPA-Decarboxylase-Hemmern (DDCI) bei erwachsenen Patienten mit Morbus Parkinson mit motorischen End-of-dose-Fluktuationen, bei denen unter diesen Kombinationen keine Stabilisierung erreicht werden kann, in den Markt eingeführt.
- Das IQWiG hielt die vom pharmazeutischen Unternehmer (pU) vorgelegten Daten aufgrund einer kurzen Studiendauer für ungeeignet zur Bewertung des Zusatznutzens.
- Abweichend davon hielt die AkdÄ eine Bewertung dieser Daten trotz der begrenzten Studiendauer für sinnvoll. Sie sah keinen Zusatznutzen für Opicapon gegenüber Entacapon, da im primären Endpunkt lediglich die Nichtunterlegenheit gezeigt wurde. Unter den sekundären Endpunkten waren CGI-C1 und PGI-C2 unter Opicapon gegenüber Entacapon besser. Spezifischere und differenziertere Scores (UPDRS3, parkinsonspezifischer Score zur Lebensqualität PDQ-394) zeigten dagegen keinen Unterschied zwischen den Behandlungsgruppen. Daher gibt es derzeit keinen Grund für den Einsatz von Opicapon.
- Nach einer ergänzenden Bewertung der fraglichen Studie durch das IQWiG entschied der G-BA abschließend, dass ein Zusatznutzen nicht gegeben ist.
Das idiopathische Parkinson-Syndrom ist eine neurodegenerative Erkrankung, die durch Bewegungsverlangsamung (Bradykinese), Rigor, Tremor und Haltungsinstabilität gekennzeichnet ist. Die Prävalenz liegt bei 100 bis 200 pro 100.000 Einwohner. Pathologisch spielt eine Degeneration dopaminerger Neurone in der Substantia nigra eine wesentliche Rolle. Bis heute steht keine kurative Therapie der Parkinson-Krankheit zur Verfügung. Thera-peutische Ziele sind daher:
- Verbesserung der Lebensqualität
- je nach Krankheitsphase die Besserung der motorischen, autonomen, kognitiven und psychiatrischen Symptome
- Vermeidung sekundärer internistischer und orthopädischer Komplikationen und Nebenwirkungen der dopaminergen Therapie.
Der Beginn der Erkrankung ist abgesehen von nichtmotorischen Prodromalsymptomen im Wesentlichen von den motorischen Kardinalsymptomen aufgrund des Dopamindefizits geprägt, sodass die erste Hauptsäule der Therapie die Gabe dopaminerg wirksamer Substanzen darstellt.
Im Verlauf der Therapie ist in der Regel nach fünf Jahren mit dem Auftreten von motorischen Wirkungsfluktuationen zu rechnen (1). Zur Behandlung von motorischen Fluktuationen, z. B. End-of-Dose-Hypokinesie eignet sich u. a. der Einsatz von Catechol-O-Methyltransferase-(COMT)Inhibitoren, die den Abbau von L-DOPA zu 3-O-Methyldopa hemmen (2).
Mit Opicapon wurde 2016 neben den zur Verfügung stehenden COMT-Hemmern nach Entacapon und Tolpicapon ein weiterer Vertreter dieser Wirkstoffgruppe in den deutschen Markt eingeführt.
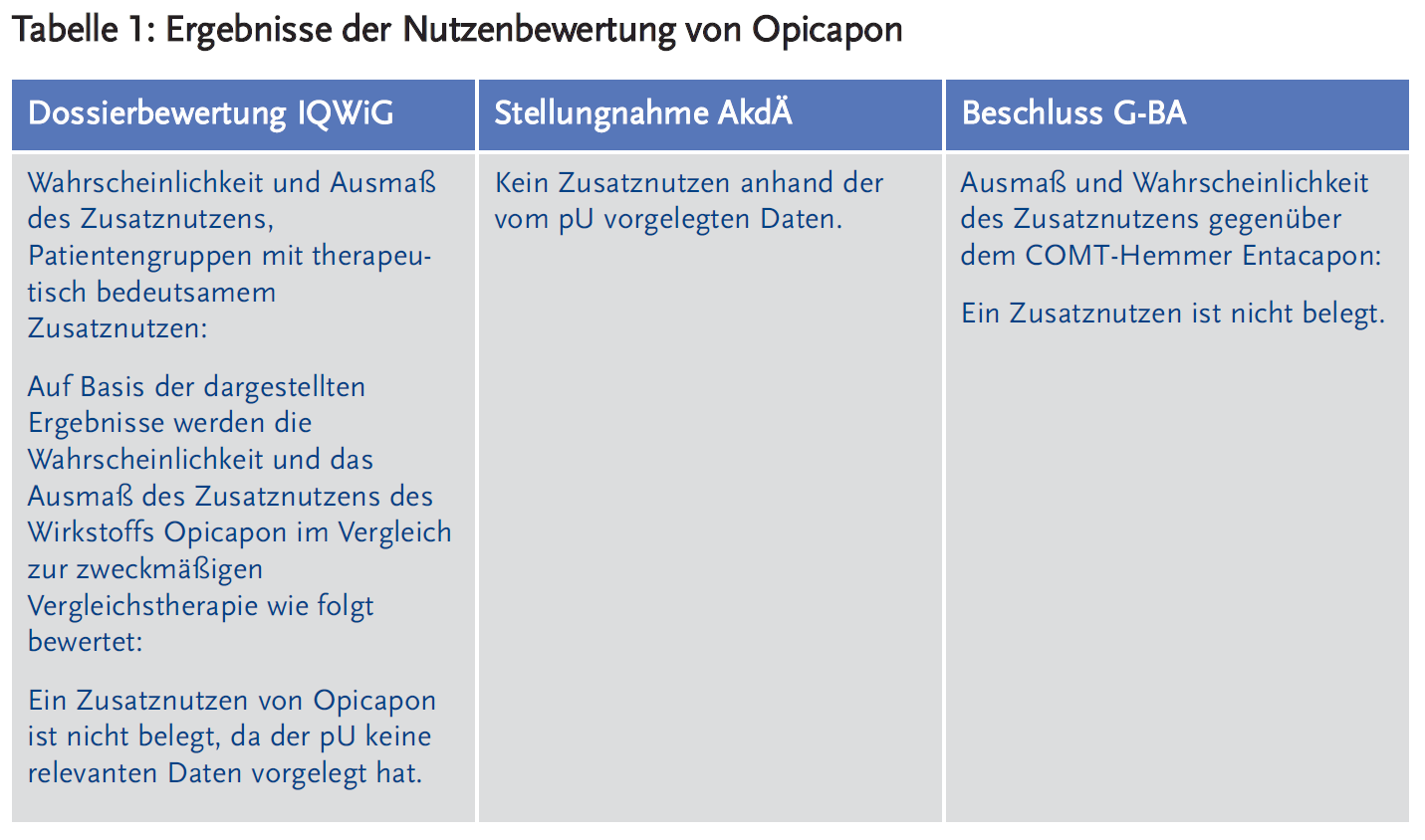
- Dossierbewertung IQWiG: Die randomisierte Doppelblindphase der zulassungsrelevanten Phase-III-Studie BIPARK-I war nach Einschätzung des IQWiG mit einer Dauer von 14 bis 15 Wochen zu kurz, da die Parkinson-Krankheit eine chronische Erkrankung mit der Erfordernis einer Dauerbehandlung ist. Somit wurden gemäß IQWiG keine relevanten Daten für die Nutzenbewertung vorgelegt, sodass der Zusatznutzen für Opicapon nicht bewertet werden konnte (3).
- Stellungnahme AkdÄ: Trotz der begrenzten Studiendauer hielt die AkdÄ eine Bewertung der vorgelegten Studienergebnisse hinsichtlich des Zusatznutzens von Opicapon für sinnvoll. Die vom pU vorgelegten Daten zeigten für Opicapon gegenüber Entacapon lediglich eine Nichtunterlegenheit im primären Endpunkt. Unter den sekundären Endpunkten waren CGI-C und der nicht validierte PGI-C unter Opicapon gegenüber Entacapon besser. In den krankheitsspezifischen und differenzierteren Scores (UPDRS, parkinsonspezifischer Score zur Lebensqualität PDQ-39) gab es dagegen keinen Unterschied zwischen den Behandlungsgruppen. Bezüglich des Nebenwirkungsprofils verwies die AkdÄ auf den Vorteil der vorliegenden ärztlichen Langzeiterfahrung mit Entacapon. Die AkdÄ sah daher keinen Zusatznutzen für Opicapon (5).
- Beschluss des G-BA: In der vom G-BA beauftragten ergänzenden Bewertung der BIPARK-I-Studie fand das IQWiG zu den parkinsonspezifischen Endpunkten sowie zu Nebenwirkungen weder positive noch negative Effekte von Opicapon im Vergleich zu Entacapon. Auch hier wurde angemerkt, dass die Beobachtung eines verbesserten PGI-C unter Opicapon mit den Ergebnissen der parkinsonspezifischen Skalen (UPDRS und PDQ-39) und den Nebenwirkungen nicht konsistent war. Wodurch die PGI-C-Ergebnisse bedingt sind, bleibt letztlich unklar (4). Die Robustheit des Effektes beim Gesundheitszustand wurde aufgrund der unterschiedlichen Ergebnisse abhängig von der Methodik der Auswertung (Zusammenfassung entweder von zwei oder drei Kategorien) als fraglich betrachtet. Darüber hinaus wurde dieser Effekt nicht durch Vorteile in anderen, insbesondere motorischen Endpunkten gestützt. Für den G-BA ist daher die methodische Unsicherheit zu groß, um mit hinreichender Sicherheit eine Relevanz des gemessenen Unterschiedes anzunehmen und einen Zusatznutzen festzustellen (6;7). Abschließend kam der G-BA zu dem Ergebnis, dass der Zusatznutzen von Opicapon nicht belegt ist.
Literatur
- Kalia LV, Lang AE: Parkinson's disease. Lancet 2015; 386: 896-912.
- Stocchi F, Rascol O, Kieburtz K et al.: Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol 2010; 68: 18-27.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): IQWiG-Berichte - Nr. 470 Opicapon - Nutzenbewertung gemäß § 35a SGB V - Auftrag A16-61 - Version 1.0:https://www.iqwig.de/download/A16-61_Opicapon_Nutzenbewertung-35a-SGB-V.pdf
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): IQWiG-Berichte - Nr. 489 Opicapon - Addendum zum Auftrag A16-61- Nutzenbewertung gemäß § 35a SGB V - Auftrag A17-04 - Version 1.0:https://www.iqwig.de/download/A17-04_Opicapon_Addendum-zum-Auftrag-A16-61_V1-0.pdf
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Opicapon), Nr. 470, A16-61, Version 1.0, Stand: 22. Dezember 2016:http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Opicapon/index.html
- Kassenärztliche Bundesvereinigung (KBV): Frühe Nutzenbewertung - Opicapon:http://www.kbv.de/html/28273.php
- Gemeinsamer Bundesausschuss (G-BA): Bundesanzeiger:Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a des Fünften Buches Sozialgesetzbuch (SGB V) - Opicapon
Fußnoten
1 Clinical Global Impression of Change
2 Patient Global Impression of Change
3 Unified Parkinson Disease Rating Scale
4 Parkinson’s Disease Questionnaire
