Sitagliptin (Januvia®, Xelevia®) (frühe Nutzenbewertung, Neubewertung nach Ablauf der Befristung)
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln/neu zugelassenen Indikationen. Ziel ist es, den Ärzten eine Information zu neu zugelassenen Arzneimitteln bei Markteinführung und nach der frühen Nutzenbewertung des Gemeinsamen Bundesausschusses (G-BA) (§ 35a Absatz 1 SGB V) zeitnah zur Verfügung zu stellen.
„Neue Arzneimittel“ bei Markteinführung enthält Informationen zu Indikation und Bewertung sowie zu klinischen Studien und unerwünschten Arzneimittelwirkungen neu zugelassener Arzneimittel/neu zugelassener Indikationen in der Europäischen Union (EU). Diese basieren auf den Angaben des Europäischen Öffentlichen Bewertungsberichts (EPAR) der Europäischen Arzneimittel-Agentur (EMA) und weiteren zur Markteinführung vorliegenden Daten aus klinischen Studien.
Nach dem Verfahren zur frühen Nutzenbewertung wird der Zusatznutzen eines neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ zur Nutzenbewertung und des Beschlusses des G-BA zur Nutzenbewertung dargestellt.
In Kürze
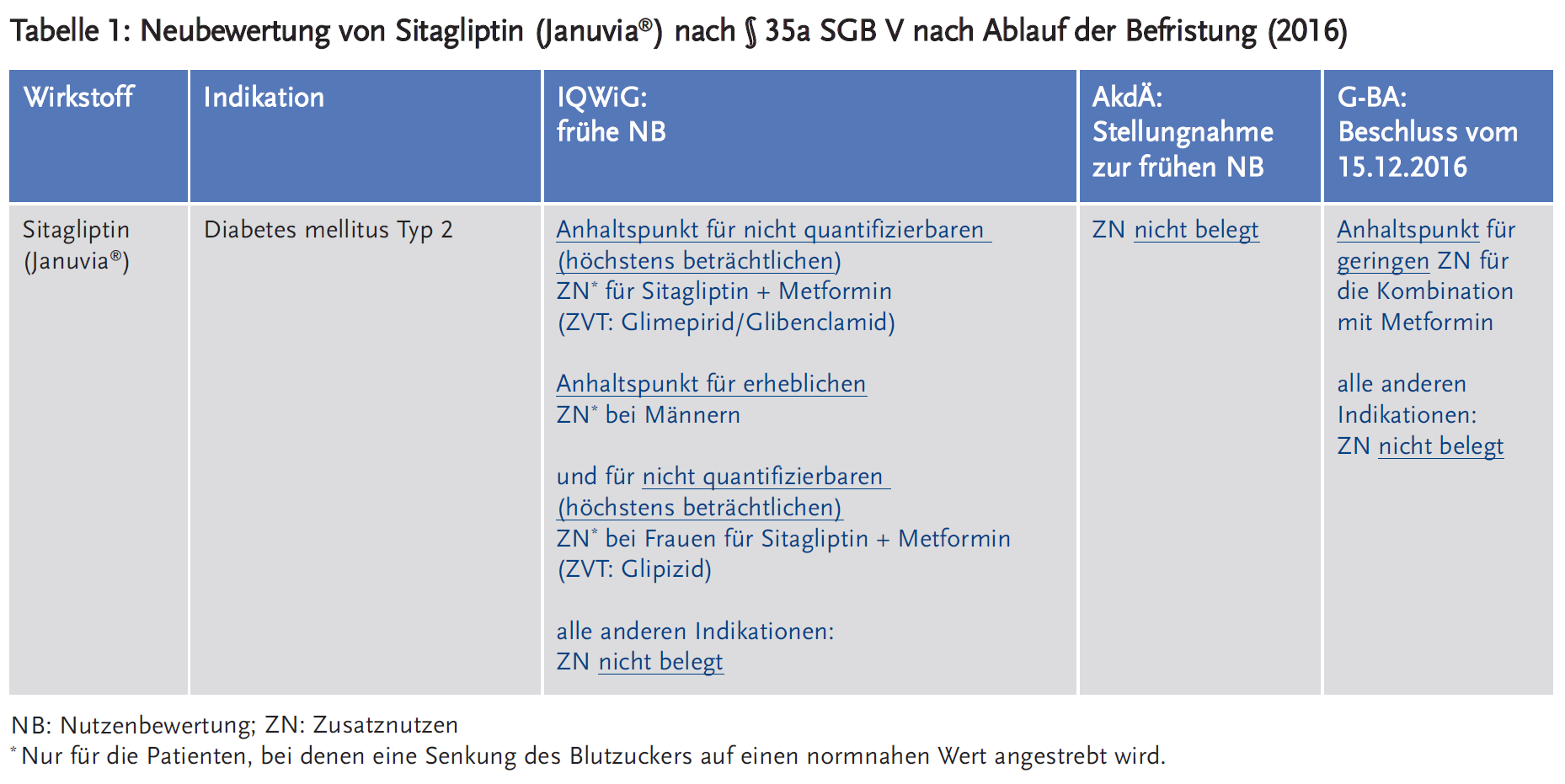
- Sitagliptin ist als Mono- und Kombinationstherapie bei erwachsenen Patienten mit Diabetes mellitus Typ 2 zugelassen.
- Die erste Nutzenbewertung nach § 35a SGB V erfolgte 2013: Der G-BA sah einen Anhaltspunkt für geringen Zusatznutzen für die Monotherapie und die Zweifachtherapie Sitagliptin + Metformin aufgrund der Verringerung nicht schwerer Hypoglykämien. Der Beschluss wurde aufgrund des Mangels an Daten zur kardiovaskulären Sicherheit, zur Gesamtmortalität und zum generellen Sicherheitsprofil befristet.
- Für die erneute Nutzenbewertung nach Ablauf der Befristung legte der pharmazeutische Unternehmer (pU) 2016 neue Daten aus den HARMONY-3- und TECOS-Studien vor. Hinsichtlich Mortalität und Morbidität konnten diese keinen Zusatznutzen von Sitagliptin belegen.
- Die Relevanz der in der HARMONY-3-Studie gezeigten signifikanten Verminderung der symptomatischen Hypoglykämien (Blutzucker ≤ 70 mg/dl) unter Sitagliptin ist aus Sicht der AkdÄ fraglich, da sie höchstwahrscheinlich auf die schnelle Dosissteigerung der Vergleichstherapie im Kontrollarm zurückzuführen war.
- Der G-BA beschloss 2016 einen Anhaltspunkt für geringen Zusatznutzen für die Kombination mit Metformin, in allen anderen Indikationen war der Zusatznutzen nicht belegt.
Sitagliptin (Januvia®, Xelevia®) ist ein Dipeptidylpeptidase-4(DPP-4)-Inhibitor. Durch eine Erhöhung des Spiegels der Inkretinhormone Glucagon-like Peptid 1 (GLP 1) und Glucose-dependent insulinotropic Polypeptid (GIP) steigert es die Insulinsynthese und senkt die Glucagonkonzentration (1;2). Dadurch werden die Nüchtern- und postprandialen Glukosekonzentrationen bei Patienten mit Typ-2-Diabetes gesenkt.
Sitagliptin ist zugelassen als Monotherapie, als orale Zweifachtherapie in Kombination mit Metformin, einem Sulfonylharnstoff oder einem Thiazolidindion sowie als orale Dreifachtherapie in Kombination mit Metformin und einem Sulfonylharnstoff und zur Kombinationstherapie mit Insulin (mit oder ohne Metformin). Der Wirkstoff darf unter der Voraussetzung eingesetzt werden, dass eine Monotherapie mit Metformin oder anderen Antidiabetika, zusammen mit einer Diät und Bewegung, den Blutzucker nicht ausreichend kontrolliert oder die Anwendung von Metformin ungeeignet erscheint (1;2).
Für die erneute Bewertung von Sitagliptin legte der pU 2016 lediglich die Neuauswertung der P024-Studie und die Daten der HARMONY-3-Studie für Sitagliptin in Kombination mit Metformin und die Daten der P260-Studie für Sitagliptin mit Insulin vor. Des Weiteren wurde die TECOS-Studie zu allen Fragestellungen der Kombinationstherapie vom pU vorgelegt, die als Auflage der U. S. Food and Drug Administration (FDA) zum Ausschluss kardiovaskulärer Risiken neu zugelassener Antidiabetika initiiert wurde (3).
Das IQWiG leitete für Sitagliptin in Kombination mit Metformin einen Anhaltspunkt für einen nicht quantifizierbaren (höchstens beträchtlichen) Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie (ZVT) (Glimepirid/Glibenclamid) aufgrund der signifikanten Reduktion der symptomatischen Hypoglykämien ab. Auch wurde ein Anhaltspunkt für einen erheblichen Zusatznutzen bei Männern und für einen nicht quantifizierbaren (höchstens beträchtlichen) Zusatznutzen bei Frauen gegenüber der ZVT Glipizid aufgrund der signifikanten Reduktion der Gesamtmortalität, der symptomatischen Hypoglykämien sowie der schweren Hypoglykämien festgestellt. Der Zusatznutzen gegenüber Sulfonylharnstoffen galt allerdings nur für die Patienten, bei denen eine Senkung des Blutzuckers auf einen normnahen Wert angestrebt wurde. Für alle anderen Indikationen war der Zusatznutzen nicht belegt (4).
Aus Sicht der AkdÄ konnte hinsichtlich Mortalität und Morbidität ein Nutzen von Sitagliptin gegenüber der ZVT durch keine der neuen Studien belegt werden. Zwar wurde in der neu ausgewerteten P024-Studie (Sitagliptin + Metformin vs. Glipizid + Metformin) ein signifikanter Vorteil hinsichtlich der Gesamtmortalität bei Männern unter Sitagliptin gezeigt, allerdings ließ die Art der aufgetretenen Todesfälle (plötzlicher Herztod, Infarkte, Krebstod und Sepsis) keinen Zusammenhang mit der ZVT Glipizid erkennen. Die signifikante Verminderung der symptomatischen Hypoglykämien und der schweren Hypoglykämien in dieser Studie war wegen der aus heutiger Sicht inadäquaten Studienkonzeption und der im Vergleichsarm verfolgten schnellen Dosissteigerung nicht interpretierbar. Dies galt auch für die in der HARMONY-3-Studie (Sitagliptin + Metformin vs. Glimepirid + Metformin) gezeigten signifikanten Verminderung der symptomatischen Hypoglykämien unter Sitagliptin. Die Studie P260 für die Indikation Sitagliptin + Insulin + ggf. Metformin im Vergleich zur ZVT Humaninsulin + Metformin ist nach Einschätzung der AkdÄ für die Bewertung des Zusatznutzens nicht relevant (5). Als Grund hierfür wird die Studienkonzeption mit dem Vergleich von Sitagliptin vs. Placebo als Add-on zu einer Therapie mit Insulin + ggf. Metformin gesehen, bei der im Kontrollarm keine Therapieeskalation, keine Dosisanpassung und keine Dosisoptimierung des Insulins vorgesehen war und/oder durchgeführt wurde, obwohl dies für einen relevanten Anteil indiziert war.
Aus Sicht der AkdÄ liefert auch die TECOS-Studie wegen ihrer Grundkonzeption keine geeigneten Daten für Aussagen zum Zusatznutzen von Sitagliptin in Kombination mit anderen Antidiabetika (5).
Der G-BA sah in seinem Beschluss vom 15.12.2016 für die Kombination Sitagliptin mit Metformin einen Anhaltspunkt für einen geringen Zusatznutzen aufgrund der Vermeidung von Nebenwirkungen (bestätigte, symptomatische Hypoglykämien). In allen anderen Indikationen sah der G-BA den Zusatznutzen als nicht belegt an (6).
Aus Sicht des G-BA erlaubt die TECOS-Studie keine direkten Aussagen gegenüber der jeweiligen ZVT in den einzelnen Therapieregimen, da Typ-2-Diabetiker mit kardiovaskulären Vorerkrankungen unterschiedlicher Diabetesstadien und -therapien eingeschlossen und individuell behandelt wurden. Die Studie liefert jedoch in ihrer Gesamtheit neue Erkenntnisse für die Nutzenbewertung. Die gezeigten Vorteile hinsichtlich der symptomatischen Hypoglykämien für Sitagliptin in Kombination mit Metformin konnten durch diese Langzeitdaten nicht bestätigt und nicht widerlegt werden, da der pU zu diesem Endpunkt keine geeigneten Daten vorgelegt hatte. Die statistisch signifikanten Ergebnisse zu Retinopathien zuungunsten von Sitagliptin sowie auch zur Hospitalisierung aufgrund von Hyperglykämien zugunsten von Sitagliptin lassen sich aus Sicht des G-BA nicht abschließend beurteilen. Die TECOS-Studie wirft aus Sicht des G-BA weitere Fragen bezüglich der Aussagesicherheit des Zusatznutzens von Sitagliptin auf (7).
Literatur
- MSD Sharp & Dohme GmbH: Fachinformation "Januvia® 25 mg, 50 mg, 100 mg Filmtabletten". Stand: Februar 2016.
- Berlin-Chemie AG: Fachinformation "Xelevia® 25 mg, 50 mg, 100 mg Filmtabletten". Stand: Februar 2016.
- Food and Drug Administration (FDA), Center for Drug Evaluation and Research (CDER): Guidance for Industry Diabetes Mellitus - Evaluating Cardiovascular Risk in New Antidiabetic Therapies to Treat Type 2 Diabetes:http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm071627.pdf
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Sitagliptin - Nutzenbewertung gemäß § 35a SGB V:https://www.iqwig.de/download/A16-44_Sitagliptin_Nutzenbewertung-35a-SGB-V.pdf
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Sitagliptin, Nr. 444, A13-44, Version 1.0, 30.09.2013 (neues Anwendungsgebiet):http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Sitagliptin/Neubewertung/index.html
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Sitagliptin:https://www.g-ba.de/downloads/39-261-2791/2016-12-15_AM-RL-XII_Sitagliptin_D-245.pdf
- Gemeinsamer Bundesausschuss (G-BA): Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Sitagliptin:https://www.g-ba.de/downloads/40-268-4131/2016-12-15_AM-RL-XII_Sitagliptin_D-245_TrG.pdf
vorab online
Dieser Artikel wurde am 8. März 2017 vorab online veröffentlicht.
