Saxagliptin (Onglyza®) und Saxagliptin/Metformin (Komboglyze®) (frühe Nutzenbewertung, Neubewertung nach Ablauf der Befristung)
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln/neu zugelassenen Indikationen. Ziel ist es, den Ärzten eine Information zu neu zugelassenen Arzneimitteln bei Markteinführung und nach der frühen Nutzenbewertung des Gemeinsamen Bundesausschusses (G-BA) (§ 35a Absatz 1 SGB V) zeitnah zur Verfügung zu stellen.
„Neue Arzneimittel“ bei Markteinführung enthält Informationen zu Indikation und Bewertung sowie zu klinischen Studien und unerwünschten Arzneimittelwirkungen neu zugelassener Arzneimittel/neu zugelassener Indikationen in der Europäischen Union (EU). Diese basieren auf den Angaben des Europäischen Öffentlichen Bewertungsberichts (EPAR) der Europäischen Arzneimittel-Agentur (EMA) und weiteren zur Markteinführung vorliegenden Daten aus klinischen Studien.
Nach dem Verfahren zur frühen Nutzenbewertung wird der Zusatznutzen eines neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ zur Nutzenbewertung und des Beschlusses des G-BA zur Nutzenbewertung dargestellt.
In Kürze
- Saxagliptin und Saxagliptin/Metformin sind bei erwachsenen Patienten mit Diabetes mellitus Typ 2 zugelassen.
- Die erste frühe Nutzenbewertung nach § 35a SGB V erfolgte 2013: Der G-BA beschloss einen Anhaltspunkt für einen geringen Zusatznutzen nur für die Zweifachtherapie Saxagliptin + Metformin sowie für die Fixkombination Saxagliptin/Metformin aufgrund der Vermeidung nicht schwerer Hypoglykämien.
- Der Beschluss wurde aufgrund des Mangels an Daten zur kardiovaskulären Sicherheit, zur Gesamtmortalität und zum generellen Sicherheitsprofil befristet.
- Für die erneute Nutzenbewertung nach Ablauf der Befristung legte der pharmazeutische Unternehmer (pU) 2016 neue Daten aus der SAVOR-TIMI-53-Studie vor. Hinsichtlich der Mortalität und der Morbidität konnten diese keinen Zusatznutzen von Saxagliptin gegenüber Placebo belegen. Sie warfen vielmehr Sicherheitsfragen auf, da unter Saxagliptin signifikant mehr Fälle von Krankenhauseinweisungen wegen kardialer Dekompensation und von Hypoglykämien auftraten.
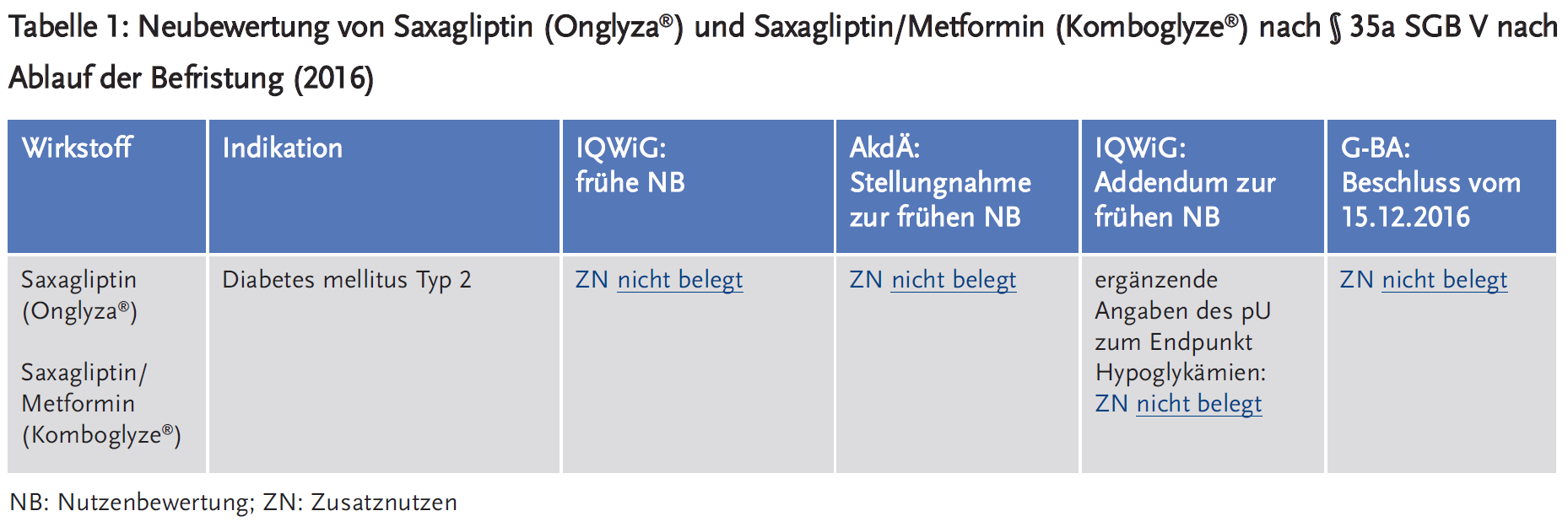
- Der G-BA beschloss 2016 in keiner der bewerteten Indikationen einen Zusatznutzen für Saxagliptin und Saxagliptin/Metformin.
Saxagliptin (Onglyza®) ist ein Dipeptidylpeptidase-4(DPP-4)-Inhibitor. Durch Erhöhung des Spiegels der Inkretinhormone Glucagon-like Peptid 1 (GLP 1) und Glucose-dependent insulinotropic Polypeptid (GIP) bewirkt es eine Steigerung der Insulinsynthese sowie eine Senkung der Glucagonkonzentration (1). Dadurch werden die Nüchtern- und postprandialen Glukosekonzentrationen bei Patienten mit Typ-2-Diabetes gesenkt. In der Fixkombination mit Metformin (Komboglyze®) werden zusätzlich durch die Hemmung der Glukoneogenese und der Glykogenolyse in der Muskulatur eine Verminderung der hepatischen Glukoseproduktion, eine Erhöhung der Insulinsensitivität und Verbesserung der peripheren Glukoseaufnahme und -verwertung sowie eine Verzögerung der intestinalen Glukoseresorption erzielt (2).
Saxagliptin ist zugelassen als Monotherapie, in Zweifachkombination mit Metformin, einem Sulfonylharnstoff oder einem Thiazolidindion sowie als orale Dreifachtherapie mit Metformin und einem Sulfonylharnstoff. Darüber hinaus kann es mit Insulin (mit oder ohne Metformin) kombiniert werden. Der Wirkstoff darf nur eingesetzt werden, wenn eine Monotherapie mit Metformin oder anderen Antidiabetika, zusammen mit einer Diät und Bewegung, den Blutzucker nicht ausreichend kontrolliert oder wenn die Anwendung von Metformin ungeeignet erscheint (1).
Die Fixkombination Saxagliptin/Metformin ist zugelassen als Ergänzung zu Diät und Bewegung bei erwachsenen Patienten mit Typ-2-Diabetes mellitus, die mit der maximal verträglichen Dosis von Metformin allein nicht ausreichend kontrolliert sind, sowie als Dreifach-Kombinationstherapie mit Insulin oder einem Sulfonylharnstoff, wenn die bisherige Therapie allein den Blutzucker nicht ausreichend kontrolliert (2).
Die frühe Nutzenbewertung von Saxagliptin und Saxagliptin/Metformin erfolgte erstmalig 2013. Die AkdÄ schloss sich der Bewertung vom IQWiG an, dass ein Zusatznutzen von Saxagliptin bzw. Saxagliptin/Metformin in keiner der bewerteten Fragestellungen belegt war, da der pU keine geeigneten Daten für die Bewertung des Zusatznutzens vorgelegt hatte (3-6).
Der G-BA beschloss dagegen einen Anhaltspunkt für einen geringen Zusatznutzen für Saxagliptin in Kombination mit Metformin sowie für die Fixkombination Saxagliptin/Metformin (7;8). Begründet wurde dies mit der Vermeidung nicht schwerer Hypoglykämien. Aufgrund fehlender Daten zur kardiovaskulären Sicherheit, zur Gesamtmortalität und zum generellen Sicherheitsprofil wurde dieser Beschluss zunächst bis zum 01.10.2015 und danach bis zum 01.07.2016 befristet (9;10).
Für die erneute Bewertung 2016 legte der pU neben den bereits bekannten Daten die Ergebnisse der SAVOR-TIMI-53-Studie vor, die als Auflage der U. S. Food and Drug Administration (FDA) zum Ausschluss kardiovaskulärer Risiken neu zugelassener Antidiabetika initiiert wurde (11). Hinsichtlich der Mortalität und der Morbidität wurde kein Zusatznutzen von Saxagliptin gegenüber Placebo belegt: Die Endpunkte traten in beiden Therapiearmen gleich häufig auf. Die Studiendaten werfen vielmehr Zweifel an der Sicherheit von Saxagliptin auf, da im Vergleich zu Placebo signifikant mehr Fälle von Krankenhauseinweisungen wegen kardialer Dekompensation und von Hypoglykämien auftraten (12).
Die AkdÄ stimmte der Bewertung des IQWiG zu, dass sich weder für Saxagliptin noch für Saxagliptin/Metformin ein Zusatznutzen in den bewerteten Indikationen belegen lässt (13-16). Im Rahmen des Stellungnahmeverfahrens reichte der pU weitere Daten zum Endpunkt Hypoglykämien in der Studie SAVOR-TIMI 53 ein. Diese waren aus Sicht des IQWiG aufgrund methodischer Mängel bei der Subgruppenbildung nicht verwertbar (17).
Der G-BA sah in seinem Beschluss vom 15.12.2016 in keiner der Indikationen einen Zusatznutzen für Saxagliptin oder Saxagliptin/Metformin (18;19). Vielmehr zeigten die vorgelegten Daten aus Sicht des G-BA zusätzliche Nachteile von Saxagliptin, die insbesondere auf den negativen Ergebnissen des Endpunktes „Hospitalisierung aufgrund von Herzinsuffizienz“ basierten. Die SAVOR-TIMI-53-Studie konnte keine positiven, dagegen aber ein relevantes negatives Ergebnis in einem kardiovaskulären Endpunkt aufzeigen (20).
Für die Fixkombination Saxagliptin/Metformin lagen aus Sicht des G-BA keine auswertbaren Daten aus der Studie SAVOR-TIMI 53 für die Patienten vor, die eine zulassungskonforme Kombinationstherapie bekommen hatten. Weitere Studien, die bereits bei der Erstbewertung eingereicht wurden, konnten die Fragestellungen der Befristung nicht beantworten (21).
Literatur
- AstraZeneca AB: Fachinformation "Onglyza® 2,5 mg Filmtabletten, Onglyza® 5 mg Filmtabletten". Stand: April 2016.
- AstraZeneca AB: Fachinformation "Komboglyze® 2,5 mg/850 mg Filmtabletten, Komboglyze® 2,5 mg/1000 mg Filmtabletten". Stand: Juli 2016.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Saxagliptin - Nutzenbewertung gemäß § 35a SGB V:https://www.iqwig.de/download/A13-01_Saxagliptin_Nutzenbewertung-35a-SGB-V.pdf
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Saxagliptin/Metformin - Nutzenbewertung gemäß § 35a SGB V:https://www.iqwig.de/download/A12-16_Saxagliptin_Metformin_Nutzenbewertung_35a_SGB_V.pdf
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Saxagliptin, Nr. 174, A13-01, Version 1.0, 27.06.2013:http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin/Erstbewertung-Kombinationstherapie/index.html
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Saxagliptin/Metformin, Nr. 152, A12-16, Version 1.0, 13.02.2013:http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin-Metformin/Erstbewertung/index.html
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin:https://www.g-ba.de/downloads/39-261-2795/2016-12-15_AM-RL-XII_Saxagliptin_D-243.pdf
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin/Metformin:https://www.g-ba.de/downloads/39-261-1705/2013-05-02_AM-RL-XII_Saxagliptin%20Metformin_BAnz.pdf
- Gemeinsamer Bundesausschuss (G-BA): Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin:https://www.g-ba.de/downloads/40-268-2521/2013-10-01_AM-RL-XII_Saxagliptin_TrG.pdf
- Gemeinsamer Bundesausschuss (G-BA): Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin/Metformin:https://www.g-ba.de/downloads/39-261-1705/2013-05-02_AM-RL-XII_Saxagliptin%20Metformin_BAnz.pdf
- Food and Drug Administration (FDA), Center for Drug Evaluation and Research (CDER): Guidance for Industry Diabetes Mellitus - Evaluating Cardiovascular Risk in New Antidiabetic Therapies to Treat Type 2 Diabetes:http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm071627.pdf
- Scirica BM, Bhatt DL, Braunwald E et al.: Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369: 1317-1326.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Saxagliptin - Nutzenbewertung gemäß § 35a SGB V:https://www.iqwig.de/download/A16-42_Saxagliptin_Nutzenbewertung-35a-SGB-V.pdf
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Saxagliptin/Metformin - Nutzenbewertung gemäß § 35a SGB V:https://www.iqwig.de/download/A16-43_Saxagliptin-Metformin_Nutzenbewertung-35a-SGB-V.pdf
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Saxagliptin, Nr. 442, A16-42, Version 1.0, 29. September 2016:http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin/Neubewertung-Kombinationstherapie/index.html
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Saxagliptin/Metformin, Nr. 443, A16-43, Version 1.0, 29. September 2016:http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Saxagliptin-Metformin/Neubewertung/index.html
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Saxagliptin und Saxagliptin/Metformin (Diabetes mellitus Typ 2) – Addendum zu den Aufträgen A16-42 und A16-43:https://www.g-ba.de/downloads/92-975-1674/2016-12-15_AM-RL-XII_Saxagliptin_D-243_Addendum.pdf
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin:https://www.g-ba.de/downloads/39-261-2795/2016-12-15_AM-RL-XII_Saxagliptin_D-243.pdf
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin/Metformin:https://www.g-ba.de/downloads/39-261-2796/2016-12-15_AM-RL-XII_Saxagliptin-Metformin_D-244.pdf
- Gemeinsamer Bundesausschuss (G-BA): Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin:https://www.g-ba.de/downloads/40-268-4133/2016-12-15_AM-RL-XII_Saxagliptin_D-243_TrG.pdf
- Gemeinsamer Bundesausschuss (G-BA): Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Saxagliptin/Metformin:https://www.g-ba.de/downloads/40-268-4134/2016-12-15_AM-RL-XII_Saxagliptin-Metformin_D-244_TrG.pdf
vorab online
Dieser Artikel wurde am 10. März 2017 vorab online veröffentlicht.
