Empagliflozin (Jardiance®), Empagliflozin/Metformin (Synjardy®) (frühe Nutzenbewertung)
Hinweise zur Erstellung der Information „Neue Arzneimittel“
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln/neu zugelassenen Indikationen. Ziel ist es, den Ärzten eine Information zu neu zugelassenen Arzneimitteln bei Markteinführung und nach der frühen Nutzenbewertung des Gemeinsamen Bundesausschusses (G-BA) (§ 35a Absatz 1 SGB V) zeitnah zur Verfügung zu stellen. „Neue Arzneimittel“ bei Markteinführung enthält Informationen zu Indikation und Bewertung sowie zu klinischen Studien und unerwünschten Arzneimittelwirkungen neu zugelassener Arzneimittel/neu zugelassener Indikationen in der Europäischen Union (EU). Diese basieren auf den Angaben des Europäischen Öffentlichen Bewertungsberichts (EPAR) der Europäischen Arzneimittel-Agentur (EMA) und weiteren zur Markteinführung vorliegenden Daten aus klinischen Studien. Nach dem Verfahren zur frühen Nutzenbewertung wird der Zusatznutzen eines neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ zur Nutzenbewertung und des Beschlusses des G-BA zur Nutzenbewertung dargestellt.
Empagliflozin (Jardiance®), Empagliflozin/Metformin (Synjardy®)* (frühe Nutzenbewertung)
In Kürze
- Mit Empagliflozin wurde nach Dapagliflozin und Canagliflozin 2014 ein weiterer Inhibitor des Natrium-Glukose-Cotransporters 2 (SGLT-2) in den deutschen Markt eingeführt.
- Empagliflozin ist als Mono- und Kombinationstherapie bei erwachsenen Patienten mit Diabetes mellitus Typ 2 zugelassen.
- In der frühen Nutzenbewertung nach § 35a SGB V aus dem Jahr 2014 sah der Gemeinsame Bundesausschuss (G-BA) für Empagliflozin keinen Anhalt für einen Zusatznutzen.
- Der pharmazeutische Unternehmer (pU) hat eine erneute Nutzenbewertung wegen neuer wissenschaftlicher Erkenntnisse beantragt.
- In der vom pU vorgelegten EMPA-REG-Outcome-Studie zeigte sich ein statistisch signifikanter Vorteil für Empagliflozin bei der Gesamtmortalität sowie dem primären Endpunkt MACE (Major Adverse Cardiac Event: kardiovaskulärer Tod oder nichttödlicher Herzinfarkt bzw. Schlaganfall). Die kardiovaskuläre Sterblichkeit sank von 5,9 % auf 3,7 %, die Gesamtmortalität von 8,3 % auf 5,7 %.
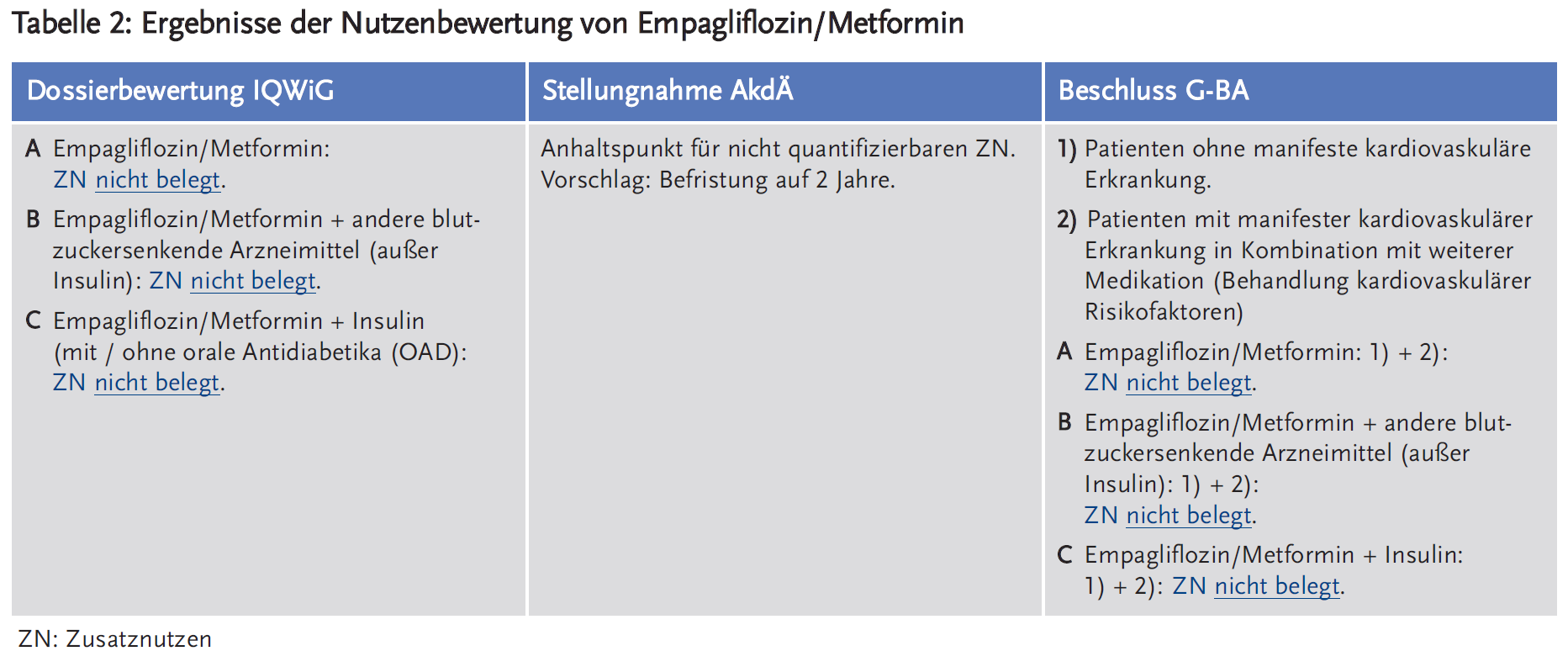
- Das IQWiG sah anhand der vom pU vorgelegten Daten weder für Empagliflozin noch für die Fixkombination Empagliflozin/Metformin einen Zusatznutzen.
- Die AkdÄ sah in ihren Stellungnahmen zur frühen Nutzenbewertung für Empagliflozin bzw. die Fixkombination Empagliflozin/Metformin einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen.
- In seinem aktuellen Beschluss zur frühen Nutzenbewertung (§ 35a SGB V) sieht der G-BA für die Monotherapie mit Empagliflozin keinen Zusatznutzen belegt. Für Patienten ohne manifeste kardiovaskuläre Erkrankung, die eine Kombination von Empagliflozin mit Metformin erhielten, bescheinigte der G-BA einen Anhaltspunkt für einen geringen Zusatznutzen. Für Empagliflozin in Kombination mit anderen blutzuckersenkenden Mitteln vergab der G-BA für die Gruppe der Patienten mit manifester kardiovaskulärer Erkrankung jeweils einen Anhaltspunkt für einen beträchtlichen Zusatznutzen. Für die Fixkombination Empagliflozin/Metformin stufte der G-BA die vorgelegten Studien für die Bestimmung eines Zusatznutzens als nicht geeignet ein. Ein Zusatznutzen ist für ihn daher nicht belegt.
Diabetes mellitus Typ 2 nimmt weltweit zu (1). In den letzten drei Dekaden hat sich die Prävalenz mehr als verdoppelt, mit geschätzten 347 Millionen erkrankten Erwachsenen (2). In Deutschland haben nach den Daten des Robert Koch-Instituts aus der Studie zur Gesundheit Erwachsener in Deutschland (DEGS) 7,2 % der erwachsenen Menschen einen Typ-2-Diabetes (3). Zu dessen Therapie existiert eine aktuelle Nationale Versorgungsleitlinie (NVL) (4).
Mit Empagliflozin wurde nach Dapagliflozin und Canagliflozin 2014 (5) ein weiterer Inhibitor des Natrium-Glukose-Cotransporters 2 (SGLT-2) in den deutschen Markt eingeführt. Empagliflozin vermindert in den proximalen Nierentubuli die Reabsorption der glomerulär filtrierten Glukose. Dadurch steigt deren renale Ausscheidung und die Plasmaglukosekonzentration verringert sich. Ein wesentlicher Nebeneffekt ist eine gesteigerte Natrium- und Wassersauscheidung.
Empagliflozin ist als Mono- und Kombinationstherapie bei erwachsenen Patienten mit Diabetes mellitus Typ 2 zugelassen (6;7).
Der G-BA hatte das IQWiG bereits 2014 erstmals mit der Nutzenbewertung des Wirkstoffs Empagliflozin gemäß § 35a SGB V beauftragt. In der Monotherapie, wenn Diät und Bewegung allein den Blutzucker nicht ausreichend kontrollieren und Metformin aufgrund von Unverträglichkeit als ungeeignet erachtet wird, war der Zusatznutzen im Vergleich zur zweckmäßigen Vergleichstherapie (ZVT) mit einem Sulfonylharnstoff (Glibenclamid oder Glimepirid) nicht belegt. Auch bei der Kombination mit Metformin gegenüber Metformin und einem Sulfonylharnstoff (Glibenclamid oder Glimepirid) entschied der G-BA, dass der Zusatznutzen nicht belegt war (8). Die AkdÄ hatte ebenfalls in ihrer Stellungnahme keinen Zusatznutzen für Empagliflozin gesehen (9).
Der pU hat eine erneute Nutzenbewertung wegen neuer wissenschaftlicher Erkenntnisse beantragt.
◾ Dossierbewertung IQWiG: Die vom pU vorgelegten Daten konnten weder für Empagliflozin noch für die Fixkombination Empagliflozin/Metformin einen Zusatznutzen belegen (10;11).
◾ Stellungnahme AkdÄ: Die unter Empagliflozin beobachtete geringere kardiovaskuläre und gesamte Mortalität bei Patienten mit Diabetes mellitus Typ 2 und manifester kardiovaskulärer Erkrankung stellt für die AkdÄ durchaus ein Ergebnis mit Patientenrelevanz dar. Allerdings wies sie darauf hin, dass dieser Effekt offensichtlich unabhängig von der Wirkung von Empagliflozin auf den Blutzucker ist (EMPA-REG-Outcome-Studie). Die AkdÄ sah daher für Empagliflozin bzw. die Fixkombination Empagliflozin/Metformin einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen. Sie schlug eine Befristung auf zwei Jahre vor, um ggf. weitere Analysen zu ermöglichen und/oder Ergebnisse aus weiteren Studien zu berücksichtigen (12;13).
◾ Beschlüsse des G-BA:
1. Empagliflozin
Zur Bewertung der Zweifachtherapie mit Metformin (Fragestellung b1, (14;15)) lagen Vierjahresdaten einer randomisierten, aktiv kontrollierten Studie, in der Empagliflozin (25 mg/Tag) mit Glimepirid (1–4 mg/Tag) jeweils in Kombination mit Metformin verglichen wurde, vor. Vorteile für Empagliflozin zeigten sich beim nichttödlichen Myokardinfarkt und bei symptomatischen Hypoglykämien. Dem standen unerwünschte Ereignisse in den Systemorganklassen der Nieren- und Harnwege und Erkrankungen der Geschlechtsorgane oder Brustdrüse gegenüber.
In der vom pU vorgelegten EMPA-REG-Outcome-Studie hatten die Patienten eine manifeste kardiovaskuläre Erkrankung. Die Studienpopulation stellte somit eine Teilpopulation der Zulassungspopulation dar und umfasste Patienten aus den Fragestellungen b) bis d) (14;15). Die Patienten erhielten 10 mg oder 25 mg Empagliflozin oder Placebo. Ein statistisch signifikanter Vorteil für Empagliflozin zeigte sich bei der Gesamtmortalität sowie den Endpunkten MACE (Major Adverse Cardiac Event: kardiovaskulärer Tod oder nichttödlicher Herzinfarkt bzw. Schlaganfall), Hospitalisierung wegen Herzinsuffizienz, schwere Herzinsuffizienz, Nierenversagen und Beginn einer dauerhaften renalen Ersatztherapie. Die kardiovaskuläre Sterblichkeit sank von 5,9 % auf 3,7 %, die Gesamtmortalität von 8,3 % auf 5,7 %. Das Risiko für die Initiierung einer Nierenersatztherapie sank um 55 %. Auf das Risiko für das Auftreten nichttödlicher Herzinfarkte oder Schlaganfälle hatte Empagliflozin keinen statistisch signifikanten Einfluss. Erkrankungen der Geschlechtsorgane oder Brustdrüse traten dagegen unter Empagliflozin deutlich häufiger auf (14).
Kombinationstherapie aus Empagliflozin und Metformin (Tabelle 1)
Bei Patienten ohne kardiovaskuläre Vorerkrankung bescheinigte der G-BA Empagliflozin einen Anhaltspunkt für einen geringen Zusatznutzen. In der Gesamtschau wurde nach Abwägung der klinischen Relevanz ein Vorteil von Empagliflozin (Vermeidung nicht-tödlicher Herzinfarkte und Hypoglykämien) trotz der Nachteile beim Auftreten von Nebenwirkungen im Bereich der Nieren- und Harnwege sowie der Geschlechts- und Brustorgane gesehen (14;15).
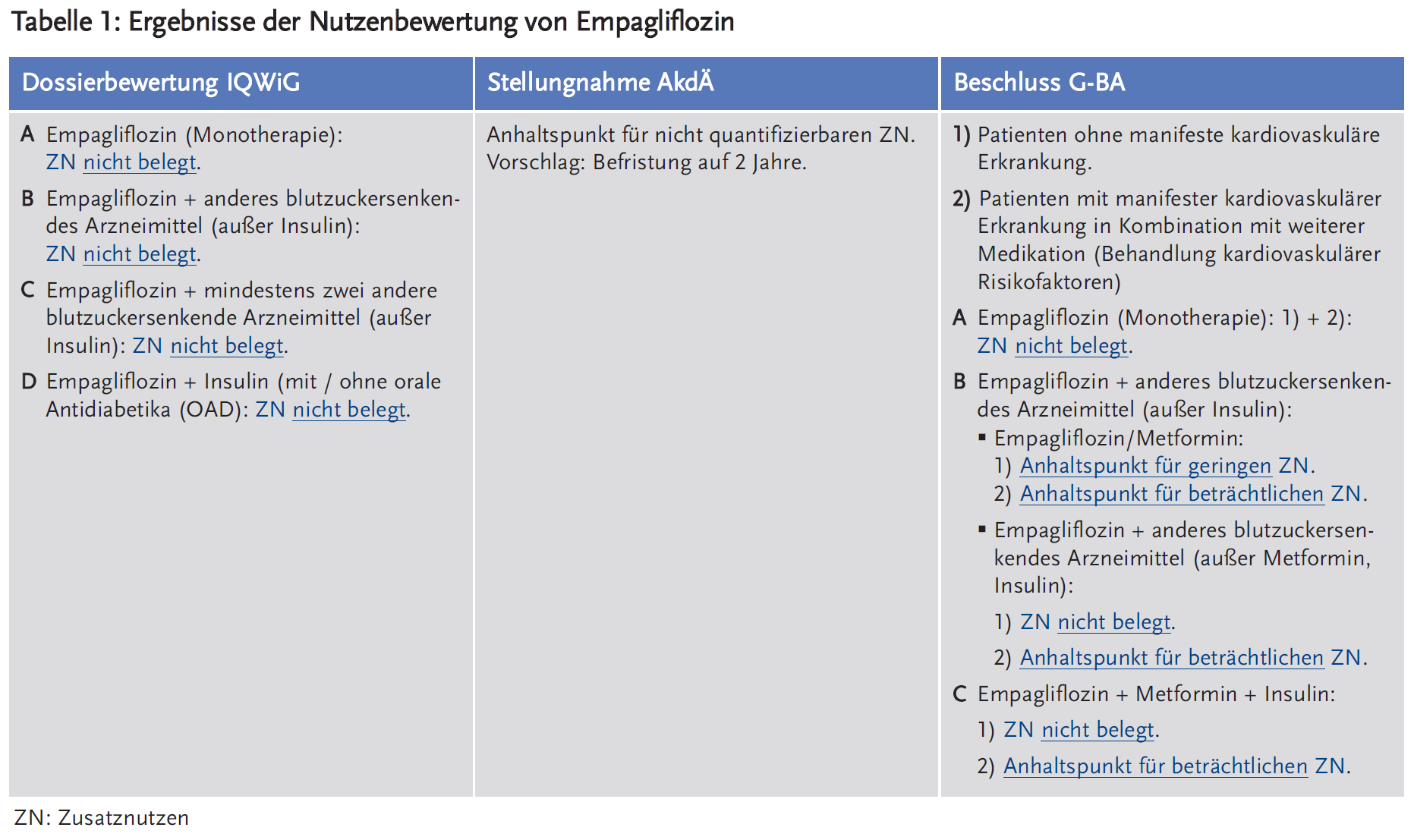
Kombinationstherapie aus Empagliflozin und weiterer Medikation bei Patienten mit manifester kardiovaskulärer Erkrankung (Tabelle 1)
Aufgrund der EMPA-REG-Studie, in der ausschließlich Patienten mit manifester kardiovaskulärer Erkrankung eingeschlossen waren, erfolgte eine Unterteilung der Patientenpopulation in Patienten ohne 1) und mit 2) manifester kardiovaskulärer Erkrankung. Auf Basis überwiegend positiver Ergebnisse dieser Studie (Vorteile gab es bei der Gesamt- und kardiovaskulären Mortalität, bei Herzinsuffizienz und Nierenversagen) wurde ein Anhaltspunkt für einen beträchtlichen Zusatznutzen festgestellt (14;15).
2. Empagliflozin/Metformin
Zur Bewertung der Zweifachtherapie Empagliflozin/Metformin wurden keine Studien mit der Fixkombination vorgelegt. Der Hersteller legte dieselben Studien wie für Empagliflozin als Monopräparat sowie neue Daten zu einem indirekten adjustierten Vergleich vor. Da die Tagesdosis von Metformin in der Fixkombination mindestens 1700 mg betrug, 30 % der Studienteilnehmer jedoch mit niedrigeren Dosierungen von Metformin behandelt wurden, präsentierte der Hersteller die Daten für die relevante Teilpopulation. Allerdings wurden für wichtige patientenrelevante Endpunkte keine Daten vorgelegt. Dazu bestanden Diskrepanzen zwischen den Angaben im Studienbericht und den vorgelegten Daten.
Des Weiteren wurde die EMPA-REG-Outcome-Studie vorgelegt, in die nur Patienten mit manifester kardiovaskulärer Erkrankung eingeschlossen waren. Analog zum Beschluss zu Empagliflozin erfolgte daher eine Unterteilung der Patientenpopulation in Patienten ohne 1) und mit 2) manifester kardiovaskulärer Erkrankung. Der Hersteller präsentierte jedoch ausschließlich die Daten der gesamten Studienpopulation und nicht die für die relevante Teilpopulation (Kombination Empagliflozin mit Metformin), die ca. 66 % der Gesamtpopulation ausmachte. Zudem gab es keine Analyse zur Übertragbarkeit der Ergebnisse der Gesamtpopulation auf die relevante Teilpopulation.
Der G-BA stufte die vorgelegten Studien als nicht geeignet ein, um einen Zusatznutzen abzuleiten. Folglich ist für den G-BA der Zusatznutzen von Empagliflozin/Metformin nicht belegt (16;17).
Literatur
- Heller T, Blum M, Spraul M et al.: [Diabetic co-morbidities: prevalences in Germany]. Dtsch Med Wochenschr 2014; 139: 786-791.
- Danaei G, Finucane MM, Lu Y et al.: National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants. Lancet 2011; 378: 31-40.
- Kurth BM: Erste Ergebnisse aus der "Studie zur Gesundheit Erwachsener in Deutschland" (DEGS). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2012; 55: 980-990.
- Bundesärztekammer (BÄK), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF), Kassenärztliche Bundesvereinigung (KBV) (Hrsg.): Nationale Versorgungsleitlinie Diabetes: Langfassung. 1. Auflage, Version 3:http://www.versorgungsleitlinien.de/themen/diabetes2/dm2_therapie/pdf/nvl-t2d-therapie-lang-3.pdf
- Lauer-Fischer GmbH: WINAPO® SQL Lauer-Taxe:www.cgm.com/lauer-fischer/index.de.jsp
- European Medicines Agency (EMA): Jardiance® - Empagliflozin: European Public Assessment Report (EPAR) (Produktinformation):http://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_Product_Information/human/002677/WC500168592.pdf
- European Medicines Agency (EMA): Synjardy® - Empagliflozin/Metformin: European Public Assessment Report (EPAR) (Produktinformation):http://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_Product_Information/human/003770/WC500187999.pdf
- Gemeinsamer Bundesausschuss (G-BA): Bundesanzeiger: Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a des Fünften Buches Sozialgesetzbuch (SGB V) - Empagliflozin:https://www.g-ba.de/informationen/nutzenbewertung/130/#tab/beschluesse
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Empagliflozin, Nr. 254, A14-26, Version 1.0, 13.11.2014. Berlin, Stand: 8. Dezember 2014.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): IQWiG-Berichte - Nr. 399 Empagliflozin - Nutzenbewertung gemäß § 35a SGB V - Auftrag A16-12 - Version 1.0:https://www.iqwig.de/download/A16-12_Empagliflozin_Nutzenbewertung-35a-SGB-V.pdf
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): IQWiG-Berichte - Nr. 400 Empagliflozin/Metformin - Nutzenbewertung gemäß § 35a SGB V - Auftrag A16-13 - Version 1.0:https://www.iqwig.de/download/A16-13_Empagliflozin-Metformin_Nutzenbewertung-35a-SGB-V.pdf
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Empagliflozin, Nr. 399, A16-12, Version 1.0, 30.05.2016. Berlin, Stand: 22. Juni 2016.
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V - Empagliflozin/Metformin, Nr. 400, A16-13, Version 1.0, 30.05.2016. Berlin, Stand: 22. Juni 2016.
- Kassenärztliche Bundesvereinigung (KBV): Frühe Nutzenbewertung - Empagliflozin:http://www.kbv.de/html/24137.php
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Empagliflozin:https://www.g-ba.de/downloads/39-261-2694/2016-09-01_AM-RL-XII_Empagliflozin_D-214_BAnz.pdf
- Gemeinsamer Bundesausschuss (G-BA): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Empagliflozin/Metformin:https://www.g-ba.de/downloads/39-261-2695/2016-09-01_AM-RL-XII_Empagliflozin_Metformin_D-215_BAnz.pdf
- Kassenärztliche Bundesvereinigung (KBV): Frühe Nutzenbewertung - Empagliflozin/Metformin:http://www.kbv.de/html/24138.php
vorab online
Der Artikel wurde am 20. Dezember 2016 vorab online veröffentlicht.
Fußnote
* zurückgezogener Artikel
