Behandlung der IgA-Nephropathie
Zusammenfassung
Die IgA-Nephropathie ist die häufigste Form einer idiopathischen Glomerulonephritis in den westlichen Industrieländern. Der klinische Verlauf einer IgA-Nephropathie ist interindividuell unterschiedlich. Die Datenlage zur Behandlung der IgA-Nephropathie ist äußerst begrenzt und die optimale Behandlungsstrategie ist unklar. In Abhängigkeit des histologischen Ergebnisses und klinischer Progressionsfaktoren wie Grad der Proteinurie sollte primär eine kontrollierte supportive Therapie mit optimaler Blutdruckregulation mittels Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS) über drei bis sechs Monate durchgeführt werden. Bei Persistenz einer signifikanten Proteinurie über 0,75 g pro Tag kann eine Steroidtherapie die Proteinurie signifikant reduzieren. Allerdings ist ein positiver Einfluss der Steroidtherapie auf den Verlauf der Nierenfunktion nicht bewiesen. Eine Steroidbolus-Therapie oder immunsuppressive Kombinationstherapie kann bei rapid progressivem Verlauf oder schweren histologischen Inflammationszeichen mit glomerulären Halbmondbildungen in Erwägung gezogen werden. Bei fortgeschrittener Erkrankung mit ausgeprägter Fibrose und Glomerulosklerose wird keine Immunsuppression empfohlen. Das therapeutische Vorgehen sollte individuell nach Abwägung der jeweiligen Vorteile und Risiken gewählt werden. Innovative Therapien werden derzeit in klinischen Studien überprüft.
Abstract
IgA nephropathy is the most form cause of idiopathic glomerulonephritis in the western developed countries. The clinical course of IgA nephropathy varies inter-individually. Data on treatment are rare and the optimal approach to the treatment of IgA nephropathy is uncertain. Depending on histomorphological results and clinical progression factors primarily a controlled supportive treatment with optimal blood pressure regulation and blockade of the renin-angiotensin-aldosteron system (RAAS) for at least three to six months is suggested. Steroid treatment may be useful to reduce persisting proteinuria above 0,75 g per day. However, a benefit of steroids on preservation of renal function has not been shown, and in addition immunosuppression was followed by an increased rate of adverse events. Steroid boli or combined immunosuppressive therapy may be applied in rapid-progressive and crescentic IgA nephropathy. In advanced diseases with chronic damage, and glomerulosclerosis no immunosuppressive treatment is recommended. Therapy of IgA nephropathy has to be provided individually after discussion of benefits and risks. Novel therapeutic regimens are in clinical investigation.
Einleitung
Die IgA-Nephropathie ist die häufigste Form einer idiopathischen Glomerulonephritis in den westlichen Industrieländern. Der klinische Verlauf einer IgA-Glomerulonephritis ist interindividuell unterschiedlich. In bis zu 50 % der betroffenen Patienten kann eine langsame Progression bis zur terminalen Niereninsuffizienz im Verlauf über 20 bis 25 Jahre beobachtet werden. Selten zeigt sich ein rapid progressiver Verlauf mit raschem Eintritt der Dialysepflichtigkeit. Die übrigen Patienten erreichen eine anhaltende klinische Remission oder zeigen eine über Jahre persistierende Mikrohämaturie und/oder Proteinurie.
Progressionsfaktoren
Folgende Risikofaktoren für eine Progredienz der Erkrankung wurden identifiziert: eingeschränkte Nierenfunktion, Hypertonie und persistierende Proteinurie > 1 g pro Tag. Weitere modifizierbare Risikofaktoren sind Übergewicht, Hypertriglyzeridämie, Hyperurikämie und Rauchen. Histologisch sind entsprechend der Oxford-Klassifikation mesangiale Hyperzellularität, segmentale Glomerulosklerose, endokapilläre Hyperzellularität und tubuläre Atrophie/interstitielle Fibrose mit einer negativen Prognose assoziiert (1). Serologisch ist die gering galaktosylierte IgA1 O-Glycoform nicht nur mit dem renalen Risiko assoziiert, sondern hat möglicherweise auch eine pathogenetische Bedeutung (2). Im Weiteren wurde spezifischen Genotypen z. B. des ACE-Gens eine prognostische Bedeutung zugewiesen (3).
Derzeit gibt es keinen spezifischen serologischen Marker zur Identifikation einer immunologischen Aktivität, sodass klinische Parameter zum Monitoring der Krankheitsaktivität herangezogen werden müssen. Eine persistierende Mikrohämaturie ist ein Zeichen der immunologischen Aktivität, jedoch nicht unbedingt ein Progressionsmarker. Eine persistierende Proteinurie über 1 g pro Tag ist ein wichtiger Risikofaktor für die Krankheitsprogression. Allerdings kann eine Zunahme der Proteinausscheidung sowohl mit der Krankheitsaktivität als auch sekundär durch eine glomeruläre Schädigung durch einen nicht immunologischen Prozess bedingt sein.
Behandlungsmöglichkeiten
Bisher existieren keine einheitlichen Behandlungsstrategien der IgA-Nephropathie. Aufgrund der häufig langsamen Progredienz der Nierenfunktionseinschränkung und der Seltenheit der Erkrankung ist es schwierig, qualitativ gute klinische Studien durchzuführen. Einige Studien belegen die positive Wirkung einer immunsuppressiven Therapie, in anderen Untersuchungen konnten vergleichbare Effekte durch supportive, d. h. antihypertensive und antiproteinurische Therapie erzielt werden.
Anhand der klinischen Symptome können die Patienten in Behandlungskategorien eingeteilt werden:
- Patienten mit einer isolierten Mikrohämaturie, minimaler Proteinurie und normaler glomerulärer Filtrationsrate (GFR) sollten regelmäßig in sechs- bis zwölfmonatigen Abständen hinsichtlich Entwicklung einer Proteinurie/Albuminurie, Nierenfunktion und Blutdruck untersucht werden.
- Bei Patienten mit einer persistierenden Proteinurie > 500 mg pro Tag sollten supportive Therapiemaßnahmen angewendet werden.
- Patienten mit einem schweren Verlauf (Proteinurie im nephrotischen Bereich, eingeschränkte Nierenfunktion, aktive histologische Veränderungen) können möglicherweise von einer zusätzlichen immunsuppressiven Therapie profitieren.
Supportive Therapiemaßnahmen entsprechend der KDIGO-Guidelines
(Kidney Disease – Improving Global Outcomes)
Renin-Angiotensin-Aldosteron-Blockade
Eine Inhibition des Angiotensins mittels ACE-Hemmer oder Angiotensinrezeptorblockade reduziert die Progression proteinurischer Nierenerkrankungen. Der positive Effekt wird sowohl durch eine Reduktion des systolischen Blutdrucks als auch durch eine Reduktion des intraglomerulären Drucks hervorgerufen (4). Eine Kombinationstherapie mit ACE-Hemmern und Angiotensinrezeptorblockern wird kontrovers diskutiert. Einerseits konnte bei Patienten mit IgA-Nephropathie in Studien mit einem kurzen Beobachtungszeitraum ein zusätzlicher antiproteinurischer Effekt beobachtet werden, andererseits existieren keine randomisierten Studien, die zeigen, dass eine Kombinationstherapie das renale Überleben verbessert. Zudem zeigte die ONTARGET-Studie, dass eine Kombinationstherapie mit Nebenwirkungen (z. B. Hyperkaliämie, Verschlechterung der Nierenfunktion) assoziiert sein kann und möglicherweise die Mortalität erhöht (5).
Omega-3-Fettsäuren
Omega-3-Fettsäuren (Fischöl) werden antiinflammatorische Eigenschaften zugeschrieben. Eine Cochrane-Metaanalyse konnte keine eindeutig positiven Effekte auf die Nierenfunktion oder Proteinurie nachweisen (4).
Immunsuppressive Therapie
Die Rolle der antiinflammatorischen und immunsuppressiven Therapie bei IgA-Glomerulonephritis ist weiterhin unklar (6). Die publizierten Studien sind vergleichsweise klein, haben ein kurzes Beobachtungsintervall oder sind als retrospektive Analyse konzipiert. Bei Patienten mit einem stabilen oder langsam progressiven Verlauf sollte vor Beginn einer immunsuppressiven Therapie zunächst eine optimale Blutdruckregulation und eine ausreichende RAAS-Blockade durchgeführt werden. Mögliche Wirkungen und Nebenwirkungen einer immunsuppressiven Therapie müssen abgewogen werden.
Glukokortikoide
Empfohlen wird eine antiinflammatorische Therapie mit Glukokortikoiden bei Patienten mit aktiven Krankheitszeichen und progressivem Krankheitsverlauf. Hierzu zählt eine Hämaturie kombiniert mit entweder einem fortschreitenden Verlust der glomerulären Filtrationsrate, mit einer persistierenden Proteinurie über 1 g pro Tag unter maximaler antiproteinurischer Therapie mittels RAAS-Blockade über drei bis sechs Monate, oder kombiniert mit histomorphologischen Aktivitätszeichen (z. B. proliferative Veränderungen).
In einer retrospektiven Analyse der großen europäischen VALIGA-Kohorte konnte gezeigt werden, dass Glukokortikoide das Risiko einer Progression unabhängig von der GFR und direkt proportional zur Höhe der Proteinurie reduzierten (7).
In einer Metaanalyse von neun klinischen Studien mit insgesamt 536 Patienten, die eine Proteinurie von über 1 g pro Tag aufwiesen, wurde gezeigt, dass eine Steroidtherapie die Inzidenz von renalen Ereignissen (50 % Reduktion der GFR, Verdopplung des Kreatinins, terminales Nierenversagen) signifikant reduziert (8). Allerdings traten in der Behandlungsgruppe auch signifikant häufiger unerwünschte Ereignisse auf.
Die aktuell publizierte STOP-IgAN-Studie, eine der größten randomisierten klinischen Studien zur Behandlung der IgA-Nephropathie, erbrachte keine Verbesserung renaler Ereignisse durch eine Steroidtherapie (9). Die sechsmonatige Run-in-Phase der Studie zeigte, dass bei 30 % der Patienten eine Reduktion der Proteinurie auf < 0,75 g pro Tag erzielt werden kann, wenn supportive Therapiestrategien (z. B. optimale Blutdruckregulation < 125/75 mmHg mittels RAAS-Blockade, Ernährungshinweise wie salzarme Kost, vermeiden eines exzessiven Proteinkonsums, Nikotinkarenz) konsequent und engmaschig kontrolliert angewendet werden. Im Rahmen der Studie konnten 162 der 337 eingeschlossenen Patienten mit bioptisch gesicherter IgA-Nephropathie, einer eGFR ≥ 30 ml/min/1,73 m2 und einer persistierenden Proteinurie von 0,75 bis 3,5 g pro Tag randomisiert werden (Kontrollarm: Fortführung der maximal supportiven Therapie, Interventionsarm: Immunsuppression additiv zur maximal supportiven Therapie). Nach drei Jahren Behandlungsdauer zeigte sich eine komplette klinische Remission bei 14 Patienten, die eine immunsuppressive Therapie erhielten (17 % versus 5 %). Interessant ist, dass eine Remission v. a. bei Patienten, die nach dem POZZI-Schema behandelt wurden, erreicht werden konnte (31 % Pozzi-Patienten, 11 % Ballardie-Patienten, 11 % Patienten mit rein supportiver Therapie). Allerdings zeigte eine immunsuppressive Therapie keinen Vorteil in Bezug auf die Nierenfunktion. Zudem hatten Patienten mit Immunsuppression ein deutlich höheres Risiko hinsichtlich Infektionen, gestörter Glukosetoleranz und Gewichtszunahme.
Neben dem Steroidregime nach POZZI mit intravenöser Steroidtherapie (1 g Methylprednisolon Monat 1, 3 und 5 sowie 0,5 mg/kg orales Prednisolon jeden zweiten Tag) wurde ein Behandlungsschema mit rein oralem Glukokortikoid (Prednison 0,8 bis 1 mg/kg pro Tag über zwei Monate gefolgt von 0,2 mg/kg pro Tag über vier Monate) untersucht (10;11). In dieser Studie konnte eine Steroidtherapie den Verlauf der Nierenfunktion positiv beeinflussen. Der renale Endpunkt wurde in 4 % im Vergleich zu 27 % in der Kontrollgruppe erreicht. Entsprechend den KDIGO-Guidelines sind beide Steroidbehandlungsregime bei IgA-Nephropathie einsetzbar (12).
Immunsuppressive Kombinationstherapie
Eine immunsuppressive Kombinationstherapie kann bei schweren Erkrankungszeichen mit rapid progressivem Verlauf oder schweren histologischen Inflammationszeichen in Erwägung gezogen werden. Zu beachten ist, dass nur eine sehr begrenzte Anzahl an Studien und Patientenverläufen vorliegt.
Das Therapieregime nach Ballardie basiert auf einer monozentrischen Studie an 38 Patienten mit fortgeschrittener Niereninsuffizienz (Kreatinin 1,5 bis 2,8 mg/dl) und einer Proteinurie von 4 g pro Tag (13). Die Patienten erhielten eine Kombinationstherapie aus Prednisolon (40 mg pro Tag mit Reduktion auf 10 mg pro Tag über zwei Jahre) kombiniert mit niedrig dosiertem Cyclosphosphamid (1,5 mg/kg pro Tag) über zwei Jahre. Die immunsuppressive Kombinationstherapie führte im Vergleich zur Kontrollgruppe zu einer signifikanten Reduktion der Proteinurie innerhalb der ersten sechs Monate, die über den Studienverlauf stabil blieb. Zusätzlich zeigten die behandelten Patienten ein besseres renales Überleben nach zwei und fünf Jahren.
Eine Kombination von Azathioprin und Glukokortikoiden scheint keinen zusätzlichen Vorteil zur singulären Steroidtherapie zu erbringen. Dies wurde in einer multizentrischen Studie an 207 Patienten mit einem Kreatinin < 2 mg/dl und einer Proteinurie > 1 g pro Tag gezeigt (14). Allerdings hatten Patienten, die zusätzlich Azathioprin erhielten, ein hohes Risiko für schwerwiegende Nebenwirkungen.
Mycophenolatmofetil
Die Ergebnisse zur Effektivität einer Mycophenolatmofetil(MMF)-Therapie bei IgA-Nephropathie sind widersprüchlich. In einer kürzlich publizierten doppelblinden placebo-kontrollierten Studie zum Einsatz von MMF bei IgA-Nephropathie zeigte sich kein Unterschied in den Behandlungsarmen hinsichtlich Proteinurie (15).
Calcineurininhibitoren
Ciclosporin A und Tacrolimus wurden in kleinen randomisierten Studien untersucht (16;17). Der Einsatz von Calcineurininhibitoren wird aufgrund der potenziellen Nephrotoxizität nicht empfohlen. Zudem wurde ein hohes Rezidivrisiko beobachtet.
Andere Interventionen
Tonsillektomie
Wenige prospektive Beobachtungen v. a. in asiatischen Populationen gaben einen Hinweis auf einen positiven therapeutischen Effekt einer Tonsillektomie in Kombination mit einer immunsuppressiven Therapie. Allerdings fehlen große randomisierte Studien mit einem ausreichenden Follow-up, ebenso ist die Übertragbarkeit auf Kaukasier kritisch zu betrachten. In der VALIGA-Kohorte konnte keine Korrelation zwischen Tonsillektomie und Nierenfunktionsverlauf detektiert werden (18). Aktuell wird die Tonsillektomie bei IgA-Nephropathie bei Kaukasiern nicht empfohlen.
Budesonid
Budesonid ist ein Glukokortikoid mit spezieller enterischer Formulierung und Freisetzung in der Ileozökalregion (Peyersche Plaques). Eine prospektive Studie an Patienten mit IgA-Nephropathie, die mit 8 mg pro Tag Budesonid behandelt wurden, zeigte eine Reduktion der Proteinurie um 23 % und eine Verbesserung der Nierenfunktion um 6 % (19). Die Ergebnisse einer randomisierten prospektiven placebokontrollierten multizentrischen Studie zum Einsatz von Budesonid bei IgA-Nephropathie (NEFIGAN-Trial) werden in Kürze erwartet.
Behandlung der rapid-progressiven IgA-Glomerulonephritis
Zur Behandlung der rapid-progressiven IgA-Glomerulonephritis liegen keine randomisierten Studien vor. Ergebnisse von älteren Beobachtungsstudien deuten darauf hin, dass intravenöse Steroidboli oder orales Cyclosphosphamid mit/ohne Plasmapherese einen positiven Einfluss auf den Verlauf haben können, solange keine fortgeschrittenen fibrotischen Veränderungen in der Nierenbiopsie zu detektieren sind (20).
Schlussfolgerung
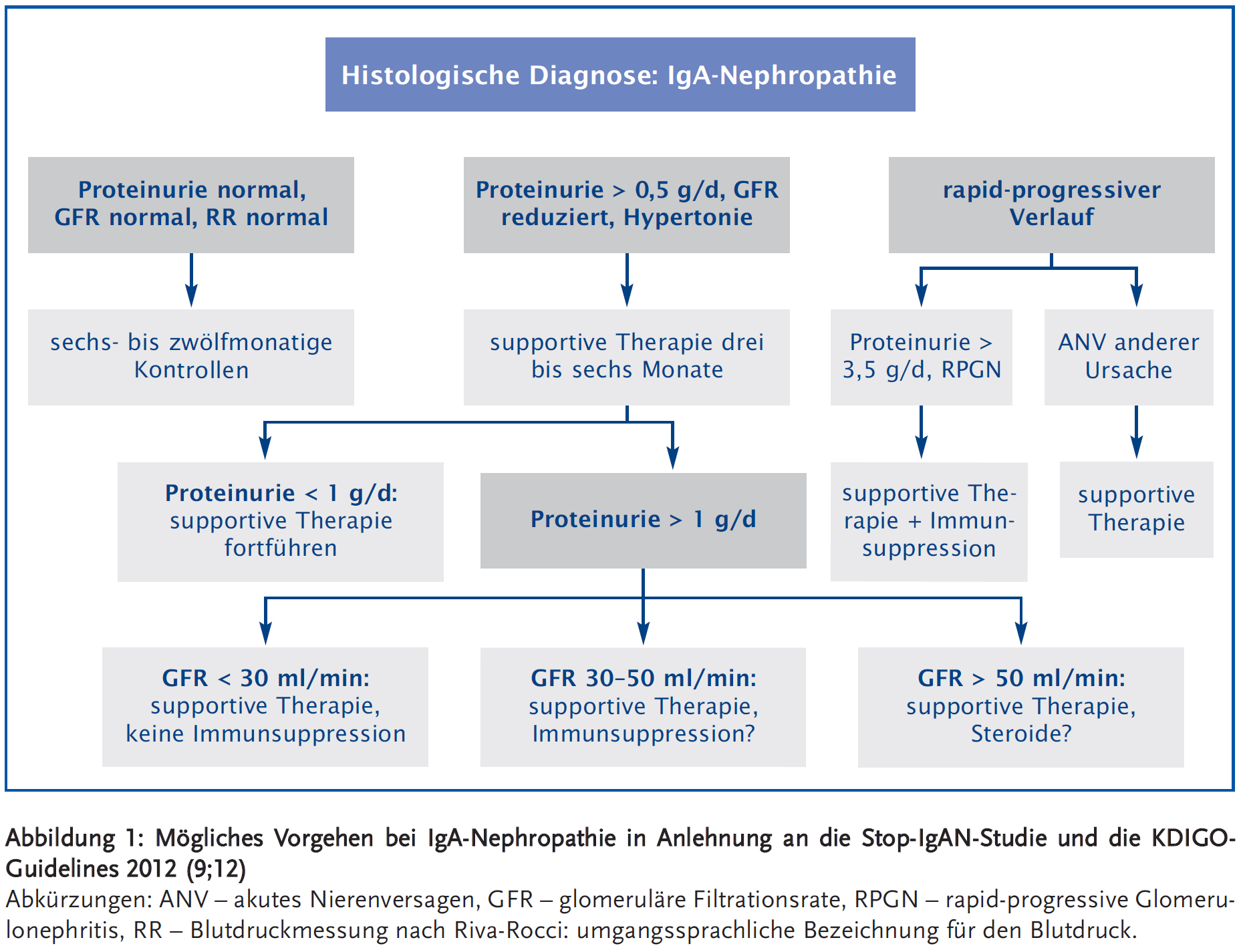
Die Datenlage zur Behandlung der IgA-Glomerulonephritis ist äußerst begrenzt. Mit der Stop-IgAN-Studie liegen erstmals Daten aus einer größeren randomisierten kontrollierten klinischen Studie vor (Abbildung 1). Zunächst wird eine kontrollierte supportive Therapie durchgeführt. Eine Therapie mit ACE-Hemmern oder Angiotensinrezeptorblockern sowie eine optimale Regulation des Blutdrucks sollten immer einer immunsuppressiven Therapie vorausgehen. Bei Patienten mit einer Proteinurie zwischen 0,75 und 3,5 g pro Tag kann eine Steroidtherapie die Proteinurie signifikant reduzieren. Allerdings ist der Einfluss der Immunsuppression auf den Verlauf der Nierenfunktion fraglich und die Immunsuppression mit einer höheren Rate an unerwünschten Ereignissen kombiniert. Eine Steroidbolus-Therapie oder eine immunsuppressive Kombinationstherapie kann bei rapid progressivem Verlauf oder schweren histologischen Inflammationszeichen mit glomerulären Halbmondbildungen in Erwägung gezogen werden. Bei fortgeschrittener Erkrankung mit ausgeprägter Fibrose und Glomerulosklerose wird keine Immunsuppression empfohlen. Das therapeutische Vorgehen sollte individuell nach Abwägung der jeweiligen Vorteile und Risiken gewählt werden. Innovative Therapien wie Einsatz eines verkapselten Steroidpräparates mit enterischer Freisetzung sowie Antikörpertherapien werden derzeit in klinischen Studien überprüft.
Fazit für die Praxis
Eine Steroidtherapie kann nicht mehr uneingeschränkt empfohlen werden, da die Progression der Niereninsuffizienz damit nicht verlangsamt wird. Bei Patienten mit rapid-progressivem Verlauf und bei nephrotischem Syndrom kann sie jedoch weiterhin erwogen werden.
Interessenkonflikte
Teilnahme als Prüfarzt an der Studie Stop-IgAN finanziert vom Bundesministerium für Bildung und Forschung.
Literatur
- Cattran DC, Coppo R, Cook HT et al.: The Oxford classification of IgA nephropathy: rationale, clinicopathological correlations, and classification. Kidney Int 2009; 76: 534-545.
- Berthoux F, Suzuki H, Thibaudin L et al.: Autoantibodies targeting galactose-deficient IgA1 associate with progression of IgA nephropathy. J Am Soc Nephrol 2012; 23: 1579-1587.
- Harden PN, Geddes C, Rowe PA et al.: Polymorphisms in angiotensin-converting-enzyme gene and progression of IgA nephropathy. Lancet 1995; 345: 1540-1542.
- Reid S, Cawthon PM, Craig JC et al. Non-immunosuppressive treatment for IgA nephropathy. Cochrane Database Syst Rev 2011; Issue 3: CD003962.
- ONTARGET Investigators, Yusuf S, Teo KK et al.: Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358:1547-1559.
- Vecchio M, Bonerba B, Palmer SC et al.: Immunosuppressive agents for treating IgA nephropathy. Cochrane Database Syst Rev 2015; Issue 8: CD003965.
- Tesar V, Troyanov S, Bellur S et al.: VALIGA study of the ERA-EDTA Immunonephrology Working Group. Corticosteroids in IgA Nephropathy: A Retrospective Analysis from the VALIGA Study. J Am Soc Nephrol 2015; 26: 2248-2258.
- Lv J, Xu D, Perkovic V et al.: TESTING Study Group Corticosteroid therapy in IgA nephropathy. J Am Soc Nephrol 2012; 23: 1108-1116.
- Rauen T, Eitner F, Fitzner C et al.: STOP-IgAN Investigators Intensive Supportive Care plus Immunosuppression in IgA Nephropathy. N Engl J Med 2015; 373: 2225-2236.
- Pozzi C, Andrulli S, Del Vecchio L et al.: Corticosteroid effectiveness in IgA nephropathy: long-term results of a randomized, controlled trial. J Am Soc Nephrol 2004; 15: 157-163.
- Manno C, Torres DD, Rossini M et al.: Randomized controlled clinical trial of corticosteroids plus ACE-inhibitors with long-term follow-up in proteinuric IgA nephropathy. Nephrol Dial Transplant 2009; 24: 3694-3701.
- Kidney Disease – Improving Global Outcomes (KDIGO): KDIGO Clinical Practice Guideline for Glomerulonephritis: Chapter 10: Immunoglobulin A nephropathy. Kidney Int Suppl 2012; 2: 209-217.
- Ballardie FW, Roberts IS: Controlled prospective trial of prednisolone and cytotoxics in progressive IgA nephropathy. J Am Soc Nephrol 2002; 13: 142-148.
- Pozzi C, Andrulli S, Pani A et al.: Addition of azathioprine to corticosteroids does not benefit patients with IgA nephropathy. J Am Soc Nephrol 2010; 21: 1783-1790.
- Hogg RJ, Bay RC, Jennette JC et al.: Randomized controlled trial of mycophenolate mofetil in children, adolescents, and adults with IgA nephropathy. Am J Kidney Dis 2015; 66: 783-791.
- Kim YC, Chin HJ, Koo HS et al.: Tacrolimus decreases albuminuria in patients with IgA nephropathy and normal blood pressure: a double-blind randomized controlled trial of efficacy of tacrolimus on IgA nephropathy. PLoS One 2013; 8: e71545.
- Liu H1, Xu X, Fang Y et al.: Comparison of glucocorticoids alone and combined with cyclosporine a in patients with IgA nephropathy: a prospective randomized controlled trial. Intern Med 2014; 53: 675-681.
- Feehally J, Coppo R, Troyanov S et al: VALIGA study of the ERA-EDTA Immunonephrology Working Group.Tonsillectomy in a European Cohort of 1,147 Patients with IgA Nephropathy. Nephron 2016; 132: 15-24.
- Smerud HK, Bárány P, Lindström K et al.: New treatment for IgA nephropathy: enteric budesonide targeted to the ileocecal region ameliorates proteinuria. Nephrol Dial Transplant 2011; 26: 3237-3242.
- Tumlin JA, Lohavichan V, Hennigar R: Crescentic, proliferative IgA nephropathy: clinical and histological response to methylprednisolone and intravenous cyclophosphamide. Nephrol Dial Transplant 2003; 18: 1321-1329.
