Update COPD-Therapie
Zusammenfassung
Die Raucherentwöhnung ist die effektivste Therapiemaßnahme zur Behandlung der COPD (chronisch obstruktive Lungenerkrankung). Die leitliniengerechte Pharmakotherapie ist in der Lage, die Prognose, die Lungenfunktion und den Gesundheitsstatus zu verbessern sowie die Symptome zu reduzieren. Kein Pharmakon ist aber in der Lage, die COPD-Letalität zu reduzieren. Basis der Pharmakotherapie ist die alleinige oder kombinierte bronchodilatative Therapie unter Verwendung eines Beta-2-Sympathomimetikums und/oder eines Anticholinergikums, wobei für die Langzeittherapie 12 Stunden oder 24 Stunden wirksame inhalative Präparate zur Verfügung stehen. Die Kombination aus beiden ist effektiver als die Einzelsubstanzen. Antientzündliche Präparate werden nur in Kombination mit einem oder zwei Bronchodilatatoren mit dem Ziel einer Exazerbationssenkung angewendet, denn der Effekt auf die Lungenfunktion ist gering. Nichtpharmakologische Maßnahmen, wie z. B. die Rehabilitation oder Lungensport, flankieren die medikamentösen Therapiebemühungen. Darüber hinaus stehen für bestimmte Patienten mit einer fortgeschrittenen COPD-Erkrankung z. B. die bronchologischen Lungenemphysem-Reduktionstechniken, die Langzeitsauerstoff- und die nichtinvasive Heimbeatmungstherapie sowie die Lungentransplantation zur Verfügung.
Abstract
Smoking cessation has been and still is the most effective therapeutic measure in treating COPD (chronic obstructive pulmonary disease). Appropriate pharmacologic therapy can improve COPD symptoms, reduce the frequency and severity of COPD exacerbations and improve health status, exercise tolerance and lung function. To date, none of the existing medications have been shown to reduce COPD mortality. Bronchodilator medications alone or in combination are the cornerstone of the treatment efforts whereas inhaled therapy with long acting compounds is preferred for long-term management. Combining bronchodilators of different pharmacological classes is more effective than the single components. Anti-inflammatory substances should only be given in order to reduce exacerbations, because they have only weak efficacy on improving lung function. Non-pharmacologic therapies, such as rehabilitation, flank pharmacological efforts or are suitable for specific patients with an advanced disease state to improve chronic hypoxia or reduce hyperkapnia.
Einleitung
Die COPD ist eine chronische Lungenerkrankung, die typischerweise progredient verläuft. In den meisten Fällen ist sie das Ergebnis einer jahre- bis jahrzehntelangen inhalativen Zigarettenrauchexposition. Entsprechend der Recherchen für das Weißbuch Lunge 2014 liegt die Prävalenz der COPD weltweit zwischen 1,3 % und 13,2 %, wobei wir für Deutschland 7,7 % annehmen (1;2). Für die Pharmakotherapie stehen kurz- und langwirksame bronchodilatative Medikamente sowie antiinflammatorische Substanzen zur Verfügung. Bronchodilatatoren können einzeln oder in Kombination gegeben werden, während die antiinflammatorischen Substanzen nur zusammen mit einem Bronchodilatator eingesetzt werden dürfen. Ziele der Pharmakotherapie sind a) die Verbesserung der Lebensqualität, Senkung der typischen Symptome (insbesondere der Dyspnoe, Husten und Auswurf) und b) die Vermeidung der die Prognose verschlechternden Exazerbationsrate und -schwere sowie c) die Verbesserung der Lungenfunktion (3).
In den letzten zwei bis drei Jahren kamen viele neue Substanzen, Fixkombinationen sowie neue Dosieraerosole und Trockenpulverinhalationssysteme auf den Markt, die aber nichts an den bewährten Grundprinzipien der Behandlung geändert haben.
Prinzipien der COPD-Therapie
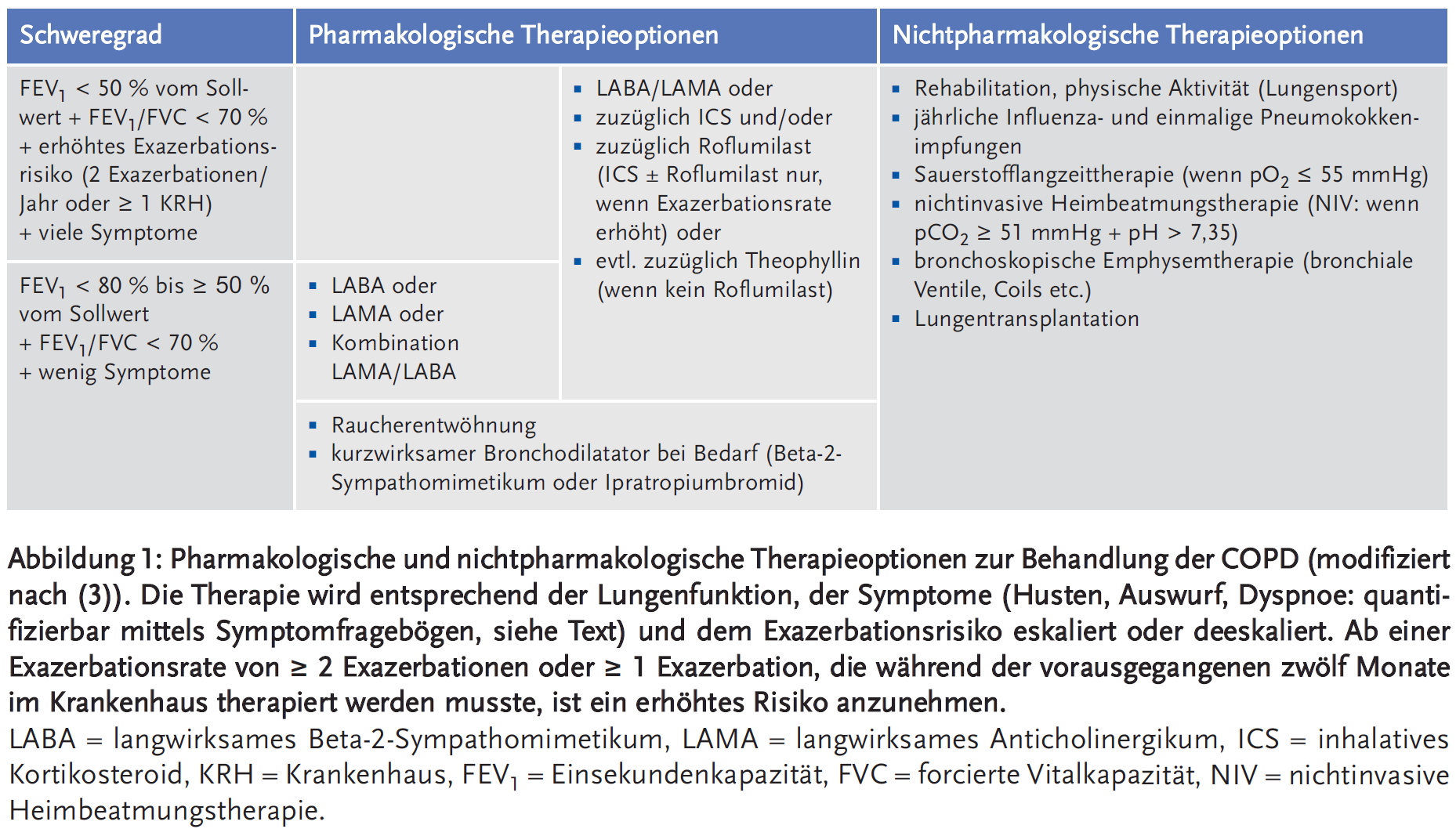
GOLD (Global Initiative for COPD) veröffentlicht jährlich eine Empfehlung zum Management der COPD. Darin werden für die Entscheidung, wann welches Pharmakon in welcher Kombination eingesetzt werden soll, neben der bisherigen lungenfunktionsbasierten Schweregradeinteilung, die Exazerbationsrate und die mittels Fragebögen quantifizierbaren Symptome für die Entscheidung berücksichtigt. Für letztere stehen der mMRC(modified British Medical Research Council)- und der CAT(COPD Assessment Test)-Fragebogen zur Verfügung (siehe Anhang). Beide erlauben eine intraindividuelle Verlaufsbeurteilung, eignen sich aber nicht für die Diagnosestellung oder den interindividuellen Vergleich.
Die drei oben genannten diagnostischen Entscheidungssäulen bedingen eine recht komplizierte, für die Praxis kaum geeignete und in sich im Detail nicht kongruente Therapieempfehlung, die deswegen hier simplifiziert wurde (Abbildung 1). Folgende Therapieprinzipien sind für die Dauertherapie der COPD zu beachten:
- Raucherentwöhnung ist die wichtigste und effektivste Therapiemaßnahme, um den Progress der Erkrankung und den jährlichen FEV1-Abfall zu verlangsamen sowie um die Prognose zu verbessern (4).
- Die Dauertherapie besteht bei der Pharmakotherapie aus einem oder zwei inhalativen Bronchodilatatoren, wobei der Einsatz eines langwirksamen Beta-2-Sympathomimetikums wirkungsäquivalent zu einem langwirksamen Parasympatholytikum ist (3). Der orale Bronchodilatator Theophyllin gilt hierbei wegen der vielen Nebenwirkungen als Mittel der letzten Wahl.
- Eskalation und Deeskalation in Abhängigkeit vom Erkrankungsstatus. Die schwere unterscheidet sich von der leichten Erkrankungsform durch eine FEV1 < 50 % vom Sollwert, > 2 Exazerbationen oder > 1 Exazerbation mit Krankenhausaufenthalt/Jahr. Ein solches erhöhtes Exazerbationsrisiko rechtfertigt die Dauertherapie mit ICS (inhalative Kortikosteroide und/oder mit Roflumilast).
- Die Pharmakotherapie wird durch nichtpharmakologische Therapiemaßnahmen flankiert. Dazu gehören insbesondere die Rehabilitation und physische Aktivität (inkl. die Teilnahme an Lungensportgruppen) (5;6).
- Ergänzend für spezielle Patientengruppen stehen weitere nichtpharmakoloigsche Therapieoptionen zur Verfügung wie die Langzeitsauerstofftherapie bei chronisch hpyoxischen Patienten (pO2 < 55 mmHg), die nichtinvasive Heimbeatmungstherapie bei hyperkapnischen Patienten (ab pCO2 > 50 mmHg), die bronchologische Emphysemtherapie (z. B. mittels bronchialer Ventile oder Coils) sowie die Lungentransplantation (7-9).
Langwirksame Beta-2-Sympathomimetika (LABA)
Es stehen 12 Stunden (Formoterol, Salmeterol) und 24 Stunden wirksame Beta-2-Sympathomimetika (Indacaterol, Olodaterol) zur Verfügung. Zwischen beiden Gruppen gibt es keine wesentlichen Wirkungsunterschiede, die eine Empfehlung für die eine oder andere Substanzgruppe rechtfertigen würde. Vielmehr sollte bei der Verschreibung auf die individuellen Patientenbedürfnisse Rücksicht genommen werden, auch in Bezug auf die Verordnung der verschiedenen Inhalationssysteme. Nachgewiesen ist die Verbesserung der Lungenfunktion (FEV1), von Lebensqualitätsparametern und von COPD-Symptomen sowie die Reduktion der Exazerbationsrate und -schwere.
Neue langwirksame Anticholinergika (LAMA)
Aclidiniumbromid ist ein 12 Stunden wirksamer und Umeclidinium-, Tiotropium- sowie Glycopyrroniumbromid sind 24 Stunden wirksame inhalative Anticholinergika. Die beste wissenschaftliche Datenlage existiert von Tiotropiumbromid, das sowohl im Handinhaler als auch im Respimat zur Verfügung steht. Auch LAMA führen zu einer Verbesserung der Lungenfunktion (FEV1), von Lebensqualitätsparametern und von COPD-Symptomen sowie zu einer Reduktion der Exazerbationsrate und -schwere. Es ist anzunehmen, dass es sich dabei um einen Klasseneffekt handelt. Die Nebenwirkungsrate entspricht ungefähr der von Placebo.
LABA/LAMA-Fixkombination
Die Kombination eines LABA mit einem LAMA ist schon immer die Empfehlung von COPD-Therapieleitlinien gewesen (3;10). 2013 ist in dieser Gruppe das erste Fixkombinationspräparat für die einmal tägliche Gabe auf den Markt gekommen, das Indacaterol (110 µg) und Glycopyrronium (50 µg) enthält. Weitere wurden zugelassen: 07/2014 Umeclidinium/Vilanterol, 11/2014 Aclidiniumbromid/Formoterol, und 08/2015 Tiotropium/Olodaterol. Die LABA/LAMA-Kombination führt zu einer zusätzlichen Verbesserung der Lungenfunktion und von Lebensqualitäts- und Symptomparametern im Vergleich zu den jeweiligen Einzelsubstanzen.
Inhalative Kortikosteroide (ICS) und ICS/LABA-Fixkombinationen
ICS ist eine bei der COPD schwach wirksame Medikamentengruppe und verbessert kaum die Lungenfunktion. Die zusätzliche Gabe eines ICS zu einem oder zwei Bronchodilatatoren ist daher vor allem bei COPD-Patienten indiziert, deren Exazerbationsrisiko erhöht ist (Abbildung 1). Es sind seit über zehn Jahren verschiedene ICS/LABA-, aber keine ICS/LAMA-Fixkombinationen auf dem Markt. Neue ICS/LABA-Produkte – Kombinationen aus altbewährten Substanzen oder komplette Neuentwicklungen – kommen aktuell laufend auf den Markt. Insbesondere Fluticason-haltige ICS-Produkte sind mit einer erhöhten Pneumonierate assoziiert. In der TORCH-Studie betrug bei der Kombination Fluticason 500 µg/Salmeterol 50 µg (zweimal pro Tag) die Number needed to treat (NNT) 44, um eine Exazerbation zu verhindern. Die Number needed to harm (NNH) betrug 16 (Induktion einer zusätzlichen ambulant erworbenen Pneumonie (11;12)).
Hemmung der Phosphodiesterase-4
Derzeit ist in Deutschland in der Gruppe der Phosphodiesterase-4(PDE-4)-Hemmer seit 2010 nur das Roflumilast zugelassen. Es kann zusätzlich zur Bronchodilatator-Therapie symptomatischen Patienten mit schwerer und sehr schwerer COPD, die an Husten und Auswurf leiden und die eine erhöhte Exazerbationsrate aufweisen, verordnet werden. Roflumilast (500 µg als Tablette) wirkt antientzündlich, senkt die vormals erhöhte Exazerbationsrate und die Rate an moderaten bis schweren Exazerbationen und hat nur einen geringen Effekt auf die Lungenfunktion (15;16). Im Placebovergleich waren allerdings Übelkeit, Bauchschmerzen, Gewichtsverlust und Kopfschmerzen häufig.
Inhalationssysteme
Die primäre Therapie besteht aus der inhalativen Therapieanwendung. Die Flut an neuen Medikamenten und die damit verbundenen neuen Inhalationssysteme wie treibgasbetriebene und Trockenpulverinhalationssysteme sind leider sehr verwirrend. Für die Praxis ergeben sich folgende Tipps: Wahl eines Inhalers, der für möglichst viele Substanzen bzw. Substanzkombinationen angeboten wird, damit der Patient bei einer Umverordnung beim gleichen Gerätetyp bleiben kann. Zudem sollte bei der Inhalerauswahl auf die Wünsche und Fähigkeiten des Patienten, den Inhaler auch richtig anwenden zu können, geachtet werden, und der Apotheker sollte nur den ärztlich verordneten Inhaler ausgeben oder andernfalls den Patienten in der korrekten Anwendung des ihm gegebenenfalls nicht bekannten Gerätes schulen (17;18).
Fazit für die Praxis
Die Therapieentscheidung basiert auf der Erkrankungsschwere der COPD. Antientzündlich wirkende Medikamente sollen nur bei einem erhöhten Exazerbationsrisiko eingesetzt werden, während die Basistherapie aus einem oder zwei verschiedenen bronchodilatativ wirkenden Medikamenten besteht. Flankiert werden diese Maßnahmen durch ein z. T. sehr spezifisches nichtpharmakologisches Therapiemanagement. Ungeachtet dessen bleibt die Raucherentwöhnung die effektivste Therapiemaßnahme. Diese Übersicht gibt einen Überblick über den aktuellen Therapiestandard inklusive der überaus spannenden Neuentwicklungen.
Interessenkonflikte
Vergütung für Vorträge von Boehringer Ingelheim, AstraZeneca, OmniaMed, Chiesi, Berlin-Chemie sowie Gutachten und Beratung für Boehringer Ingelheim, Berlin-Chemie, Almirall-Hermal, Chiesi, Elpen.
Literatur
- Geldmacher H, Biller H, Herbst A et al.: Die Prävalenz der chronisch obstruktiven Lungenerkrankung (COPD) in Deutschland. Ergebnisse der BOLD-Studie. Dtsch Med Wochenschr 2008; 133: 2609-2614.
- Gillissen A, Lommatzsch M, Prenzler A et al.: Chronisch obstruktive Lungenerkrankung (COPD). In: Gillissen A, Welte T (Hrsg.). Weißbuch Lunge 2014. Die Lunge und ihre Erkrankungen: Zur Lage und Zukunft der Pneumologie in Deutschland. Herne: Frischtexte Verlag, 2014: 47-57.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD):http://www.goldcopd.com
- Andreas S, Herth FJ, Rittmeyer A et al.: Tabakrauchen, chronisch obstruktive Lungenerkrankung und Lungenkarzinom. Pneumologie 2007; 61: 590-595.
- Steier J, Petro W: Physikalische Therapie bei COPD – Evidence Based Medicine? Pneumologie 2002; 56: 388-396.
- Gerardi D, ZuWallack R: Non-pulmonary factors affecting survival in patients completing pulmonary rehabilitation. Monaldi Arch Chest Dis 2001; 56: 331-335.
- Magnussen H, Kirsten A-M, Köhler D et al.: Leitlinien zur Langzeit-Sauerstofftherapie der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin e.V. Pneumologie 2008; 62: 748-756.
- Windisch W, Brambring J, Budweiser S et al.: Nichtinvasive und invasive Beatmung als Therapie der chronischen respiratorischen Insuffizienz. Pneumologie 2010; 64: 207-240.
- Gompelmann D, Eberhardt R, Herth FJ: Interventional pulmonology procedures: an update. Panminerva Med 2013; 55: 121-129.
- Ärztliches Zentrum für Qualität in der Medizin (ÄZQ), Bundesärztekammer (BÄK), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) (Hrsg.): Nationale Versorgungsleitlinie COPD. Langfassung. Version 1.8, April 2011.
- Suissa S, Patenaude V, Lapi F, Ernst P: Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax 2013; 68: 1029-1036.
- Suissa S . Number needed to treat in COPD: exacerbations versus pneumonias. Thorax 2013; 68: 540-543.
- Svedsater H, Dale P, Garrill K et al.: Qualitative assessment of attributes and ease of use of the ELLIPTA™ dry powder inhaler for delivery of maintenance therapy for asthma and COPD. BMC Pulm Med 2013; 13: 72.
- Bateman ED, Mahler DA, Vogelmeier CF et al.: Recent advances in COPD disease management with fixed-dose long-acting combination therapies. Expert Rev Respir Med 2014; 8: 357-379.
- Fabbri LM, Calverley PM, Izquierdo-Alonso JL et al.: Roflumilast in moderate to severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised trials. Lancet 2009; 374: 695-703.
- Calverley PM, Rabe KF, Goehring U-M et al.: Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet 2009; 374: 685-694.
- Gillissen, A. Patientenpräferenz von Inhalern. Pneumologie 2014; 68: 727-736.
- Voshaar T, App EM, Berdel D et al.: Empfehlungen für die Auswahl von Inhalationssystemen zur Medikamentenverabreichung. Pneumologie 2001; 55: 579-586.
Anhang
Einteilung der Luftnot des Modified British Medical Research Council
mMRC-Grad 0
mMRC Grad I
mMRC-Grad II
mMRC Grad III
mMRC-Grad IV
Dyspnoe bei schweren Anstrengungen
Dyspnoe bei schnellem Gehen oder bei leichten Anstiegen
langsameres Gehen als Gleichaltrige aufgrund von Dyspnoe
Dyspnoe bei Gehstrecke um 100 m
Dyspnoe beim An-/Ausziehen
CAT (COPD Assessment Test)
Der CAT bewertet das Ausmaß von Husten, Schleimmenge, Enge in der Brust, Luftnot bei Belastung (Treppe), Einschränkung in häuslichen Aktivitäten, Bedenken, das Haus zu verlassen, Schlafstörungen mit jeweils 0 bis 5 Punkten. Eine Gesamtpunktzahl bis 10 gilt als geringe Einschränkung, eine bis 20 Punkte als mäßige, eine bis 30 als hohe und über 30 als sehr hohe Einschränkung (www.catestonline.org).
