Nalmefen zur Reduktion des Alkoholkonsums bei Alkoholabhängigkeit
Nalmefen (Selincro®): für wen es zur Verfügung steht
Nalmefen (Selincro®) ist ein Opioidrezeptorantagonist und seit Februar 2013 in der EU zur Behandlung der Alkoholabhängigkeit zugelassen. Der Wirkstoff ist nicht neu; er wurde bereits im Jahr 1995 zur Behandlung der Opioidüberdosierung als Revex™ von der FDA lizensiert.
Die EMA hat Nalmefen zur Reduktion des Alkoholkonsums zugelassen. Diese Zulassung beschränkt sich jedoch auf Patienten mit einem sogenannten hohen Risikoniveau, ohne körperliche Entzugserscheinungen, für die keine sofortige Entgiftung erforderlich ist. Als hoher Konsum wird bei Männern eine Menge von > 60 g Alkohol/Tag (entspricht z. B. > 1,5 l Bier/Tag) und bei Frauen > 40 g Alkohol/Tag, (entspricht z. B. > 1 l Bier/Tag), bezeichnet. Zudem soll Nalmefen nur in Verbindung mit einer psychosozialen Unterstützung verordnet werden, die das Ziel der Therapieadhärenz und Reduktion des Alkoholkonsums verfolgt, und auch nur dann, wenn der Alkoholkonsum zwei Wochen nach einer initialen Untersuchung immer noch hoch ist (1).
Nalmefen unterliegt Verordnungseinschränkungen der Arzneimittel-Richtlinie (AM-RL). Laut dieser Richtlinie kommt ein „Mittel zur Behandlung der Alkoholabhängigkeit“ nur dann in Frage, wenn es mit dem Ziel eingesetzt wird, auf eine Abstinenztherapie hinzuführen, die aufgrund fehlender Therapiemöglichkeiten nicht zeitnah zur Verfügung steht. Ferner darf die Verordnung nur zeitlich begrenzt (drei bis maximal sechs Monate) und nur durch einen Arzt erfolgen, der in der Therapie der Alkoholabhängigkeit erfahren ist (2).
Patienten sollten Nalmefen 18 mg Tabletten einmal täglich bei Bedarf einnehmen; etwa ein bis zwei Stunden bevor sie sich gefährdet fühlen, Alkohol zu trinken. Im Falle einer Behandlung wird empfohlen, das Ansprechen auf das Arzneimittel regelmäßig (z. B. monatlich) zu kontrollieren, und in Abhängigkeit davon über die Fortsetzung der Therapie zu entscheiden (1).

Therapeutisches Spektrum
Anders als die auf dem deutschen Markt verfügbaren Arzneimittel (Acamprosat® (3)) und Naltrexon (Adepend®,(4)) wird Nalmefen nicht mit dem Ziel eingesetzt, Abstinenz aufrechtzuerhalten bzw. das Rückfallrisiko zu senken. Vielmehr soll es die Alkoholaufnahme reduzieren, indem es bei Bedarf eingenommen wird.
Ob Nalmefen damit das erste Arzneimittel ist, das bei fortdauerndem Alkoholkonsum zur Verfügung steht, wird unterschiedlich interpretiert. So hat der G-BA in seiner Frühbewertung den Opioidrezeptorantagonisten Naltrexon als Vergleichstherapie bestimmt, während bspw. das NICE zu dem Schluss kommt, dass Nalmefen als einziges Arzneimittel bei nicht alkoholabstinenten Patienten eine Zulassung besitzt (vgl. (5–7)).
Auch das therapeutische Konzept der Trinkmengenreduktion wird kritisch diskutiert. Von Befürwortern wird argumentiert, dass die Konsumreduktion ein Zwischenziel auf dem Weg zur Abstinenz darstellt, das für diejenigen Patienten von Vorteil ist, die nicht direkt zur Abstinenztherapie motiviert werden können. Ferner soll mit der Konsumreduktion eine Verringerung alkoholbedingter Gesundheitsschäden erreicht werden.
Was wir über Nalmefen wissen
In den Zulassungsstudien ESENSE 1, (8), ESENSE 2, (9) und SENSE (unveröffentlicht), wurde geprüft, ob Nalmefen plus psychosoziale Unterstützung (Teilnahme an BRENDA, (10)) die Trinkmenge (g Alkohol/Tag) oder Trinkhäufigkeit (Anzahl der schweren Trinktage/ Monat) besser reduziert als Placebo plus psychosoziale Unterstützung. Relevante Studien, die Nalmefen mit anderen Arzneimitteln zur Behandlung der Alkoholabhängigkeit verglichen hätten, gibt es nicht (11).
Nach Markteinführung hat der G-BA Nalmefen einer „frühen Nutzenbewertung“ unterzogen (6). Hierzu lagen die Ergebnisse derjenigen Teilpopulationen vor, die bei Screening und Randomisierung einen hohen Alkoholkonsum aufwiesen. Sie sollen noch am besten diejenige Population widerspiegeln, für die das Arzneimittel letztlich zugelassen wurde.
Für die Subgruppen lag zu Studienbeginn die Trinkhäufigkeit in den Behandlungsarmen zwischen ca. 19 bis 23 Tagen pro Monat. 24 Wochen später hatte sie mit Nalmefen um rund 10 bis 13 Tage und unter Placebo um rund 7 bis 10 Tage abgenommen. Die Trinkmenge lag zu Beginn zwischen 99 und 113 g Alkohol/Tag und nahm unter Nalmefen um rund 57–70 g und unter Placebo um rund 40–60 g Alkohol ab. Die Differenz zwischen Nalmefen und Placebo betrug somit zwischen 10 und 18 g Alkohol/Tag, was in etwa einer kleinen (250 ml) bzw. großen (500 ml) Flasche Bier entspricht.
Die Auswertung der Subgruppen markiert dabei eine eher großzügige Beurteilung der Wirksamkeit von Nalmefen, da Patienten mit geringerem Konsum und solche, die ihren Alkoholkonsum bereits in Erwartung einer Studienteilnahme reduziert und von Nalmefen weniger profitiert hatten, post-hoc von den Analysen ausgeschlossen wurden. Am Beispiel der Veränderung der Trinkmenge illustriert Tabelle 2 dies für die Studien ESENSE 1 und 2. Da die Abbruchraten in den Studien hoch waren (Nalmefen: 38–54 %, Placebo: 32–38 %), kamen zudem unterschiedliche Berechnungsmodelle zum Einsatz, die teilweise ebenfalls kleinere Therapieeffekte ermittelten (12).
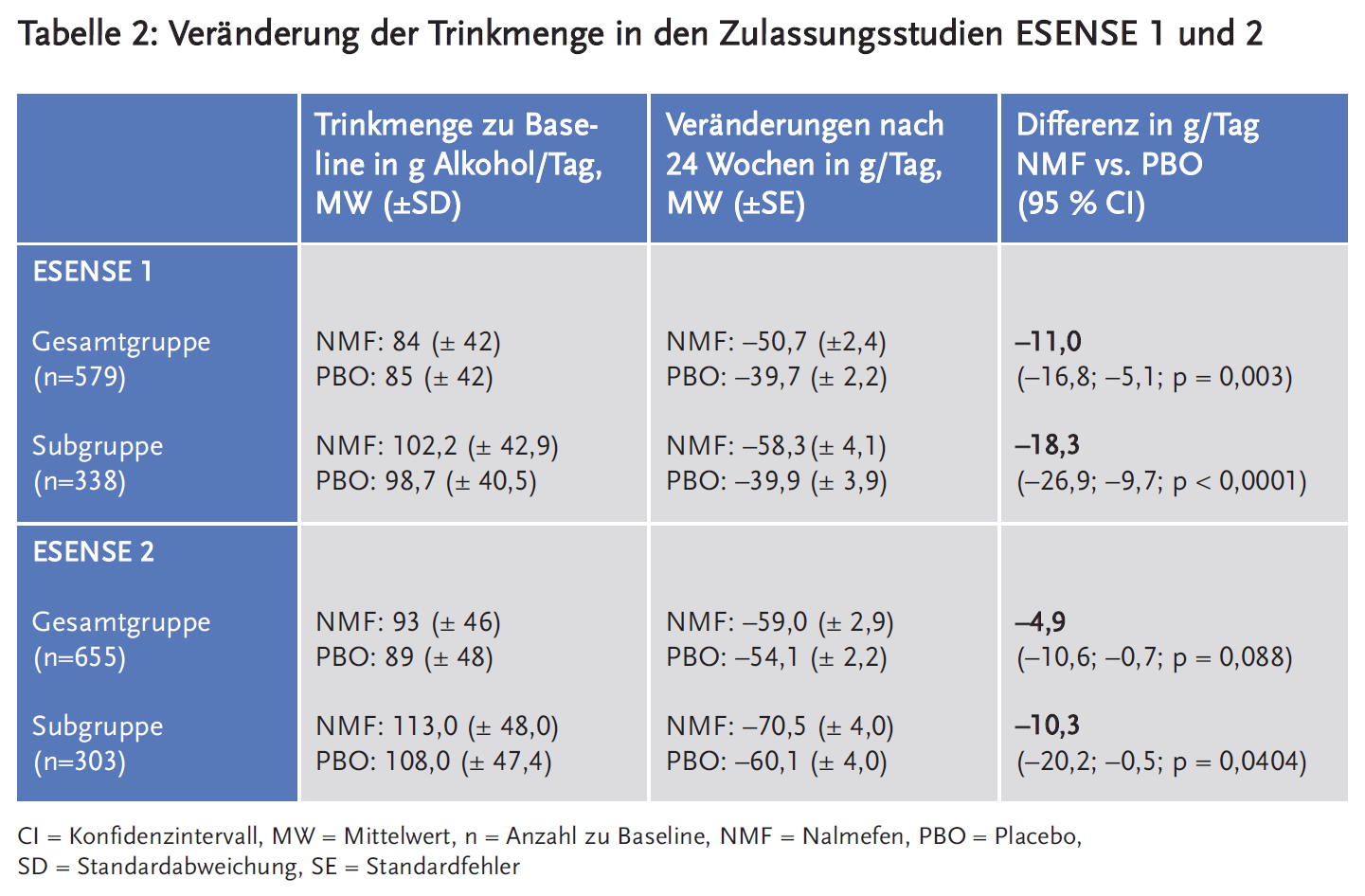
Die Unterschiede zwischen Nalmefen und Placebo hinsichtlich der Trinkmenge und Trinkhäufigkeit waren damit deutlich geringer als die Effekte, die bereits durch die Studienteilnahme und Anwendung psychosozialer Unterstützung im Placeboarm erzielt werden konnten. Für eine ausführlichere Information sind eine Reihe von Dokumenten frei verfügbar, siehe z. B. (a) die AkdÄ Stellungnahme zu Nalmefen (13), (b) die IQWiG: Dossierbewertung A14-30 Nalmefen (6), (c) das Dossier des Herstellers zur Nutzenbewertung von Nalmefen Modul 4A (14) oder (d) die NICE technology appraisal guidance 325: „Nalmefene for reducing alcohol consumption in people with alcohol dependence“ (15).
Unter den unerwünschten Arzneimittelwirkungen (UAW) waren unspezifische Beschwerden wie Übelkeit, Schwindel, Schlafstörungen und Kopfschmerzen am häufigsten. Übelkeit und Schwindel traten dabei zumeist relativ früh nach Behandlungsbeginn auf, waren aber im Verlauf deutlich rückläufig. Psychiatrische Störungen wie etwa Verwirrtheit traten bei knapp 3 % der Patienten unter Nalmefen auf, und waren damit dreimal häufiger als unter Placebo (12).
Was wir über Nalmefen (noch) nicht wissen
Dass eine moderate Verringerung von Trinkmenge und Trinkhäufigkeit über einen begrenzten Zeitraum von drei bis sechs Monaten die Wahrscheinlichkeit erhöht, dass alkoholabhängige Patienten Abstinenz erreichen, ist bisher nur eine Vermutung. In welchem Ausmaß eine moderate Reduktion des Alkoholkonsums über einige Monate mit einer relevanten Verringerung alkoholbedingter Gesundheitsschäden einhergeht, ist ebenfalls nicht bekannt.
Der Großteil der Patienten in den Studien ESENSE 1 und 2 hatte bisher noch keine Behandlung der Alkoholabhängigkeit erhalten und Patienten mit psychischen und schweren körperlichen Erkrankungen wurden von der Studienteilnahme ausgeschlossen. Damit ist unsicher, wie gut die Ergebnisse auf diejenigen Patienten übertragen werden können, für die der größte Bedarf besteht: Patienten, die trotz mehrfacher adäquater Behandlungsversuche nicht abstinent werden können.
Kosten

Off-Label-Use
Die Wahrscheinlichkeit erscheint hoch für eine Off-label-Anwendung in Form eines Einsatzes bei Patienten, die nicht die Schweregradkriterien erfüllen, die gar nicht auf eine abstinenzorientierte Therapie warten, die das Arzneimittel ohne begleitende psychosoziale Therapie einnehmen oder die die Einnahme nicht auf den zugelassenen Zeitraum beschränken.
Fazit
Die Wirksamkeit von Nalmefen in der Reduktion von Trinkmenge und Trinkhäufigkeit ist, im Verhältnis zu den Effekten, die mittels der Studienteilnahme bereits im Placeboarm erzielt werden konnten, allenfalls moderat ausgeprägt. Sie muss gegen die möglichen, zumeist unspezifischen unerwünschten Arzneimittelwirkungen (UAW) abgewogen werden.
Da die Studienpatienten nicht diejenigen Patienten widerspiegeln, für die am ehesten ein Bedarf besteht, ist die Übertragbarkeit der bisher verfügbaren Ergebnisse auf den Alltag mit Unsicherheit behaftet. Zudem erscheint das Potenzial für einen Off-Label-Gebrauch von Nalmefen hoch. Inwieweit die moderaten Effekte auch im klinischen Alltag erzielt werden können, ist daher auch davon abhängig, ob das Arzneimittel gemäß der Zulassung und Empfehlungen eingesetzt wird. Der abstinenzorientierten Therapie sollte – wann immer möglich – Vorrang eingeräumt werden.
Interessenkonflikte
Ein Interessenkonflikt wird von der Autorin verneint.
Literatur
- H. Lundbeck A/S: Fachinformation "Selincro® 18 mg Filmtabletten". Stand: Dezember 2013.
- Gemeinsamer Bundesausschuss (G-BA): Anlage III – Übersicht über Verordnungseinschränkungen und -ausschlüsse in der Arzneimittelversorgung durch die Arzneimittel-Richtlinie und aufgrund anderer Vorschriften (§ 34 Absatz 1 Satz 6 und Absatz 3 SGB V), Hinweise zur wirtschaftlichen Verordnungsweise von nicht verschreibungspflichtigen Arzneimitteln für Kinder bis zum vollendeten 12. Lebensjahr und für Jugendliche mit Entwicklungsstörungen bis zum vollendeten 18. Lebensjahr sowie Verordnungseinschränkungen und -ausschlüsse von sonstigen Produkten. Berlin, 13. Mai 2014.
- Merck Serono Europe Limited: Fachinformation "Campral®, magensaftresistente Tablette". Stand: Juni 2013.
- Orpha-Devel Handels und Vertriebs GmbH: Fachinformation "Adepend® 50 mg Filmtabletten". Stand: Mai 2013.
- National Institute for Health and Care Excellence (NICE): Evidence summary: new medicine – ESNM29: Alcohol dependence: nalmefene: www.nice.org.uk/advice/esnm29/resources/non-guidance-alcohol-dependence-nalmefene-pdf. Manchester, Dezember 2013. Zuletzt geprüft: 18. November 2014.
- Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Nalmefen:https://www.g-ba.de/informationen/nutzenbewertung/135/
- Nalmefene for alcohol dependence. Drugs and Therapeutics Bulletin 2014; 52: 54-57.
- Mann K, Bladstrom A, Torup L et al.: Extending the treatment options in alcohol dependence: a randomized controlled study of as-needed nalmefene (inclusive supplemental information). Biol Psychiatry 2013; 73: 706-713.
- Gual A, He Y, Torup L et al.: A randomised, double-blind, placebo-controlled, efficacy study of nalmefene, as-needed use, in patients with alcohol dependence (inclusive supplementary material). Eur Neuropsychopharmacol 2013; 23: 1432-1442.
- Starosta AN, Leeman RF, Volpicelli JR: The BRENDA model: integrating psychosocial treatment and pharmacotherapy for the treatment of alcohol use disorders. J Psychiatr Pract 2006; 12: 80-89.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG): Nalmefen – Nutzenbewertung gemäß § 35a SGB V. IQWiG-Berichte Nr. 257:https://www.g-ba.de/downloads/92-975-616/2014-12-01_Nalmefen_Nutzenbewertung_IQWiG.pdf
- European Medicines Agency (EMA): Selincro® – Nalmefen: European Public Assessment Report (EPAR) (Assessment Report):http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002583/WC500140326.pdf
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Stellungnahme der AkdÄ zur Nutzenbewertung nach § 35a SGB V – Nalmefen, Nr. 257, A14-30, Version 1.0, 26.11.2014:http://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Nalmefen/index.html
- Lundbeck GmbH: Dossier zur Nutzenbewertung gemäß § 35a SGBV. Nalmefen (Selincro®). Modul 4A. Reduktion des Alkoholkonsums bei erwachsenen Patienten mit Alkoholabhängigkeit. Medizinischer Nutzen und medizinischer Zusatznutzen, Patientengruppen mit therapeutisch bedeutsamem Zusatznutzen:https://www.g-ba.de/downloads/92-975-614/2014-08-28_Modul4A_Nalmefen.pdf
- National Institute for Health and Care Excellence (NICE): Nalmefene for reducing alkohol consumption in people with alcohol dependence. NICE technology apprailsal guidance 325:https://www.nice.org.uk/guidance/ta325
