Marktrücknahmen im Zuge des AMNOG
Verlust an Behandlungsoptionen oder Vereinfachung von Therapieentscheidungen – das Beispiel Lurasidon
Marktrücknahme von Lurasidon
Im Januar 2014 hatte sich die Europäische Arzneimittelagentur (EMA) für die Zulassung des Antipsychotikums Latuda® mit dem Wirkstoff Lurasidon zur Behandlung der Schizophrenie ausgesprochen. Es wurde mit der deutschen Markteinführung im November 2014 in das Verfahren der frühen Nutzenbewertung (§ 35a SGB V) aufgenommen. Im Februar 2015 stellte das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) fest, dass ein Zusatznutzen gegenüber einer Auswahl anderer Antipsychotika der zweiten Generation nicht belegt ist. Darauf folgte bereits am 1. März 2015 die Marktrücknahme durch den Hersteller – noch bevor ein Beschluss des Gemeinsamen Bundesausschuss (G-BA) über den Zusatznutzen getroffen wurde.
Ein Einzelfall?
Seit Beginn des AMNOG-Verfahrens haben Hersteller acht neue Arzneimittel im Anschluss an die Veröffentlichung der frühen Nutzenbewertung und noch vor Abschluss der Erstattungsbetragsverhandlungen aus dem Handel genommen (sogenannte „Opt-Out“, siehe GKV-Spitzenverband). Für alle diese Arzneimittel hatte das IQWiG bzw. der G-BA keinen Zusatznutzen gesehen. Dies gilt auch für weitere sieben Arzneimittel, die entweder bereits vor Beginn des AMNOG-Verfahrens oder Monate nach Preisfestsetzung aus dem Handel genommen wurden (Stand 01.04.2015, siehe Tabelle 1).
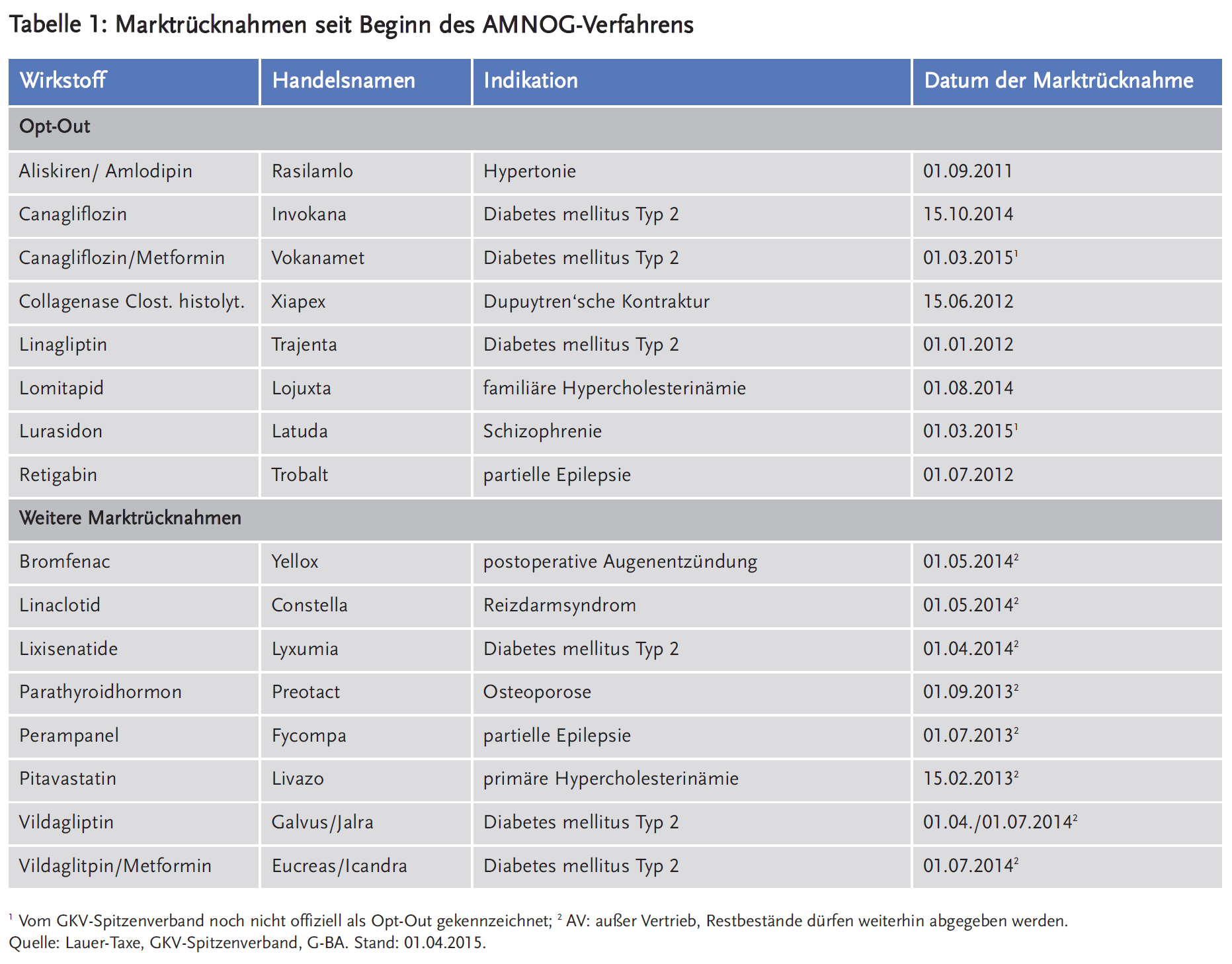
Nur unter AMNOG?
Marktrücknahmen aus wirtschaftlichen Gründen gibt es jedoch nicht erst seit oder wegen des AMNOG-Verfahrens. Ein prominentes Beispiel ist das Fertigarzneimittel MabCampath® mit dem Wirkstoff Alemtuzumab. Es wurde 2001 in der Indikation der chronisch lymphatischen Leukämie vom B-Zell-Typ (B-CLL) zugelassen und durch den Zulassungsinhaber im Jahr 2012 vom Markt genommen, um es später (2013) zu einem deutlich höheren Preis für die Behandlung der Multiplen Sklerose (als Lemtrada®) vertreiben zu können (1). Den Patienten mit B-CLL wurde so eine wichtige Behandlungsoption genommen.
In der Vergangenheit haben zudem sowohl die seit 2004 bestehende Festbetragsregelung für patentgeschützte Arzneimittel, als auch die Notwendigkeit, für sogenannte Altzulassungen umfangreiche klinische Studien einzureichen, häufiger Anlass gegeben, Arzneimittel auch aus wirtschaftlichen Gründen vom Markt zu nehmen.
Bewertung am Beispiel von Lurasidon
Selbst der Hersteller hat für Lurasidon in der Akuttherapie der Schizophrenie keine verbesserte Wirksamkeit im Vergleich mit anderen, im direkten Vergleich untersuchten Antipsychotika (Risperidon, Olanzapin, Quetiapin) gesehen. Laut IQWiG können die Studien nicht einmal zeigen, dass der Effekt auf die Schizophreniesymptomatik dem der Vergleichstherapien ebenbürtig ist. Dies steht im Einklang mit einer frühen Bewertung durch die AkdÄ (2) sowie einer aktuellen Metaanalyse von Leucht et al. (3). Darin wurde gezeigt, dass Lurasidon hinsichtlich seiner relativen Wirksamkeit am unteren Ende einer Skala von insgesamt 15 Antipsychotika rangiert.
Der Hersteller hat im AMNOG-Verfahren jedoch einen Zusatznutzen beansprucht und dies mit einer verbesserten Verträglichkeit begründet. Während die Gewichtszunahme unter Lurasidon zwar nur moderat ausgeprägt ist, zählt die extrapyramidale Störung (EP) Akathisie zu den häufigsten unerwünschten Arzneimittelwirkungen (UAW) (2). Je nach gewählter Vergleichstherapie kann Lurasidon daher für einzelne Patienten von Vorteil oder aber von Nachteil sein.
Ohne Zweifel können auch Arzneimittel ohne überlegene Wirksamkeit und selbst ohne Zusatznutzen eine Bereicherung des therapeutischen Spektrums darstellen, etwa wenn sie ein anderes UAW-Profil aufweisen und damit für Patientengruppen infrage kommen, die Kontraindikationen gegen die verfügbaren Arzneimittel besitzen (4). Lurasidon jedoch ist hinsichtlich seines UAW-Profils mit anderen verfügbaren Antipsychotika vergleichbar. Ein relevanter Verlust an Behandlungsoptionen ist nicht erkennbar.
Fazit
Auch unabhängig vom AMNOG-Verfahren wurden und werden Arzneimittel vom Hersteller aus wirtschaftlichen Gründen aus dem Handel genommen. Marktrücknahmen im Rahmen des AMNOG-Verfahrens scheinen häufig der Verhinderung einer Preisfestsetzung von Arzneimitteln zu dienen, die keinen belegten Zusatznutzen haben. In bestimmten Situationen können auch Arzneimittel ohne überlegene Wirksamkeit eine relevante Erweiterung der Therapieoptionen darstellen. Die Marktrücknahme von Lurasidon als Beispiel eines Arzneimittels ohne Zusatznutzen stellt dagegen keine klinisch relevante Einschränkung des Behandlungsspektrums dar.
Interessenkonflikte
Ein Interessenkonflikt wird von den Autorinnen verneint.
Literatur
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Information und Stellungnahme der AkdÄ zur Marktrücknahme von MabCampath® (Alemtuzumab). AkdÄ-Newsletter 2012-168 vom 24. August 2012.
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Neue Arzneimittel – Latuda® (Lurasidon): Neue Arzneimittel 2015-01 vom 16. Januar 2015.
- Leucht S, Cipriani A, Spineli L et al.: Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet 2013; 382: 951-962.
- Ujeyl M, Schlegel C, Walter S, Gundert-Remy U: Neue Arzneimittel: Verfügbarkeit von Daten zum therapeutischen Stellenwert bei Markteinführung. Dtsch Arztebl 2012; 109: 117-123.
