Influenza – welche Impfstoffe gibt es?
Influenza – Definition – Krankheitslast – Überwachung
Die Influenza ist eine Virusinfektion, die sich im Winterhalbjahr auf der Nordhemisphäre und im Sommerhalbjahr auf der Südhemisphäre der Erde epidemisch ausbreitet. Die Falldefinition des Robert Koch-Instituts (RKI) (1) beinhaltet virologisch den Influenzavirusnachweis im Rachenabstrich oder klinisch die Merkmale plötzlicher Krankheitsbeginn, Husten und mindestens eines der beiden Symptome Fieber oder Schmerzen in Kopf, Muskeln, Gliedern. Gesetzliche Meldepflicht besteht für den direkten Nachweis von Influenzaviren.
Aus den virologischen Untersuchungsergebnissen lässt sich die Krankheitslast der Influenza nicht herleiten. Sie ergibt sich vielmehr aus dem Ergebnis der jährlichen Gesundheitsberichterstattung des Bundes und den regelmäßigen Meldungen im Rahmen der Überwachung durch die über 800 Sentinel-Arztpraxen in Bezug auf virologische Untersuchungen, akute Erkrankungen der Atemwege, Arbeitsunfähigkeiten, Komplikationen, Hospitalisierungen, Todesfälle während eines Influenzageschehens.
Die Überwachung des Influenzageschehens liegt in der Verantwortung des Nationalen Referenzzentrums (NRZ) Influenza im RKI und wird von der Arbeitsgemeinschaft Influenza (AGI) koordiniert. In Europa gibt es ein European Influenza Surveillance Scheme (EISS) mit enger Zusammenarbeit der Länder und einer wöchentlichen Übermittlung virologischer und epidemiologischer Daten an die WHO.
Bei der Bewertung einer Influenzaepidemie spielen Vergleiche mit Daten aus influenzafreien Perioden eine maßgebliche Rolle. Die Differenzen zwischen den beiden Perioden werden der Influenza zugeschrieben. Im RKI-Bericht (2) zur Epidemiologie der Influenza in Deutschland − Saison 2012/2013 − wurden 7,7 Millionen Exzesskonsultationen, 4,3 Millionen Influenza-assoziierte Arbeitsunfähigkeiten und 32.000 grippebedingte zusätzliche Hospitalisierungen dokumentiert. Die Exzessmortalität wurde in diesem Bericht nicht gesondert ausgewiesen. Sie lag bei früheren Influenzaepidemien durchschnittlich zwischen 5.000 und 10.000 (3).
Influenzaviren – Vorkommen – Variabilität – Mutationen
Influenzaviren sind RNA-Viren aus der Familie der Orthomyxoviridae. Sie finden sich nicht nur beim Menschen, sondern auch bei Säugetieren und Vögeln. Humanmedizinische Bedeutung haben die Serotypen A, B und C. Der Typ A breitet sich epidemisch und pandemisch aus, die Typen B und C vornehmlich epidemisch oder sporadisch.
Das Genom der Influenzaviren besteht aus 8 RNA-Segmenten, die mehrere Oberflächenglykoproteine (Subtypen) – 15 Hämagglutinine (HA) und 9 Neuraminidasen (N) − kodieren. Die Segmentierung ermöglicht den Viren eine genetische Variabilität. Diese manifestiert sich häufig (jährlich) mit einer geringen Antigenmutation (Punktmutation = „drift“) oder seltener (im Abstand von Jahrzehnten) mit einer drastischen Antigenmutation (Rekombination = „shift“). Da Hämagglutininproteine (HA) und Neuraminidaseproteine (N) auf verschiedenen RNA-Molekülen kodiert werden, können verschiedene Virussubtypen bei Doppelinfektionen im gleichen Wirt untereinander ausgetauscht werden. Dieser Vorgang wird als „Reassortment“ bezeichnet. Er liegt dem Antigenshift zugrunde und führt zu einer sprunghaften Veränderung der Antigenspezifität mit neuen A-Subtypen. Dieses Phänomen konnte beim Übergang der Influenzaviren von Vögeln auf Schweine und von dort auf Menschen als Ausgangspunkt für die „asiatische Grippe“ erkannt werden. Schweine fungierten hier sozusagen als „Mischgefäße“ für das Reassortment.
Wegen fehlender Immunität in der Bevölkerung kann es durch diese neuen Virusvarianten zu einer dramatischen Virusausbreitung über alle Erdteile – Pandemie − häufig mit schweren und tödlichen Krankheitsverläufen kommen. Punktmutationen (Antigendrift) führen dagegen bei Influenza-A- und seltener bei Influenza-B-Viren zu geringeren Veränderungen der Oberflächenantigene und sind verantwortlich für Epidemien oder lokal begrenzte Ausbrüche.
Influenzaimpfstoffe – Bewertung – Vielfalt – Risiko/Nutzen
Zwischen jährlich sich ändernden Strukturen der Influenzaviren und der Herstellung dazu passender Impfstoffe besteht ein Wettlauf, der trotz engmaschiger Überwachung mit frühzeitiger Virusidentifizierung keine Garantie für eine optimale Impfstoffzusammensetzung bietet. Mertens (4) schrieb kürzlich: „Die Influenzaimpfung ist nicht die beste Impfung, aber sicher das Beste, was wir gegen Influenza haben.“
Zur Bewertung eines Influenzaimpfstoffs dienen folgende Kriterien: Die Immunogenität (immunogenicity) eines Impfstoffs sagt etwas über seine Fähigkeit zur Erzeugung einer Immunität aus. Die humorale Immunität kann anhand der Antikörperbildung gemessen werden. Antikörper gegen Hämagglutinine bewirken eine Virusneutralisierung. Antikörper gegen Neuraminidasen behindern eine Virusfreisetzung. Natürliche Influenzaexpositionen hinterlassen einen Antikörpertiter, dessen Spezifität von den induzierenden Influenzavirusantigenen und dessen Höhe vom Alter der Person abhängt. Serumantikörpertiter von mindestens 1:40 im Hämagglutinationstest korrelieren mit der Schutzwirkung (5).
Effektivität bzw. Protektivität (effectiveness) eines Impfstoffs sagt etwas über seine Schutzwirkung aus. Für ihre Bestimmung sind Studien erforderlich. Prinzipiell werden zwei repräsentative Probandengruppen prospektiv und randomisiert mit einem Impfstoff vs. Placebo während einer oder mehrerer Influenzasaisons vergleichsweise auf den (signifikanten) Unterschied definierter Endpunkte wie Morbidität, Hospitalisierung, Mortalität kontrolliert. Ihre Evidenz ist aussagekräftiger als epidemiologische Beobachtungsstudien (Fall-Kontroll- oder Kohortenstudien) und diese weisen wiederum eine bessere Evidenz auf als Untersuchungen von Surrogatmarkern (Antikörperbestimmungen) (6).
Traditionelle inaktivierte Spalt- und Subunit-Impfstoffe sind weder hinsichtlich Immunogenität noch hinsichtlich Effektivität optimal. Eine kritische Auswertung bisheriger Studien verweist zwar auf gute Verträglichkeit, vermochte aber keine eindeutigen Aussagen zur Wirkung der Influenzaimpfstoffe zu treffen. Die Autoren fordern eine methodisch einwandfreie Studie, die über mehrere Influenzasaisons läuft (7).
Im Epidemiologischen Bulletin Nr. 42 (8) konnte man am 19.10.2009 folgenden Satz lesen: „Die saisonale Grippewelle auf der Nordhalbkugel 2008 endet mit dem Beginn der Pandemie H1N1 im April 2009.“ Einerseits wird in dieser offiziellen Verlautbarung auf den milden Verlauf der H1N1-Influenza – der sog. Schweinegrippe − hingewiesen. Andererseits hat die globale Verbreitung der Influenzaviren die WHO zur Proklamation einer Pandemie veranlasst, die ihrerseits zu einem beachtenswerten Forschungs- und Produktionsschub von Influenzaimpfstoffen geführt hat.
Wenn wir von einem optimalen Influenzaimpfstoff − unabhängig vom saisonalen Influenzageschehen und unabhängig vom Alter der Impflinge – auch noch weit entfernt sind (6), gibt es inzwischen eine Vielzahl von Influenzaimpfstoffen, die sich gegenüber konventionellen inaktivierten Influenza-Spalt- und Untereinheitenimpfstoffen als überlegen erwiesen haben (9). Squalen-basierte Adjuvanzsysteme, Einbau von Virusantigenen in virosomale Partikel, attenuierte Lebendviren und alternative Applikationsformen (intradermal, nasal) haben in den letzten Jahren zu einer Verbesserung der Influenzaimpfstoffe beigetragen.
Ein Impfstoff mit dem Adjuvanz MF59 – ein Öl-in-Wasser-Impfstoffverstärker − war im Vergleich zu einem trivalenten inaktivierten Impfstoff bei Senioren mit einem zu 25 % reduzierten Risiko für Hospitalisierung infolge Influenza assoziiert (10). In einer prospektiven Studie verhinderte ein virosomaler Impfstoff bei geimpften im Vergleich zu ungeimpften Kindern in 88 % der Fälle (2 vs. 18/1000) eine laborbestätigte Influenza (11). Ein attenuierter Lebendimpfstoff verbesserte bei Kindern im Alter bis zu 17 Jahren die Erkrankungsrate um 48 % (4,2 vs. 8,1 %) im Vergleich zu einem inaktivierten trivalenten Impfstoff (12).
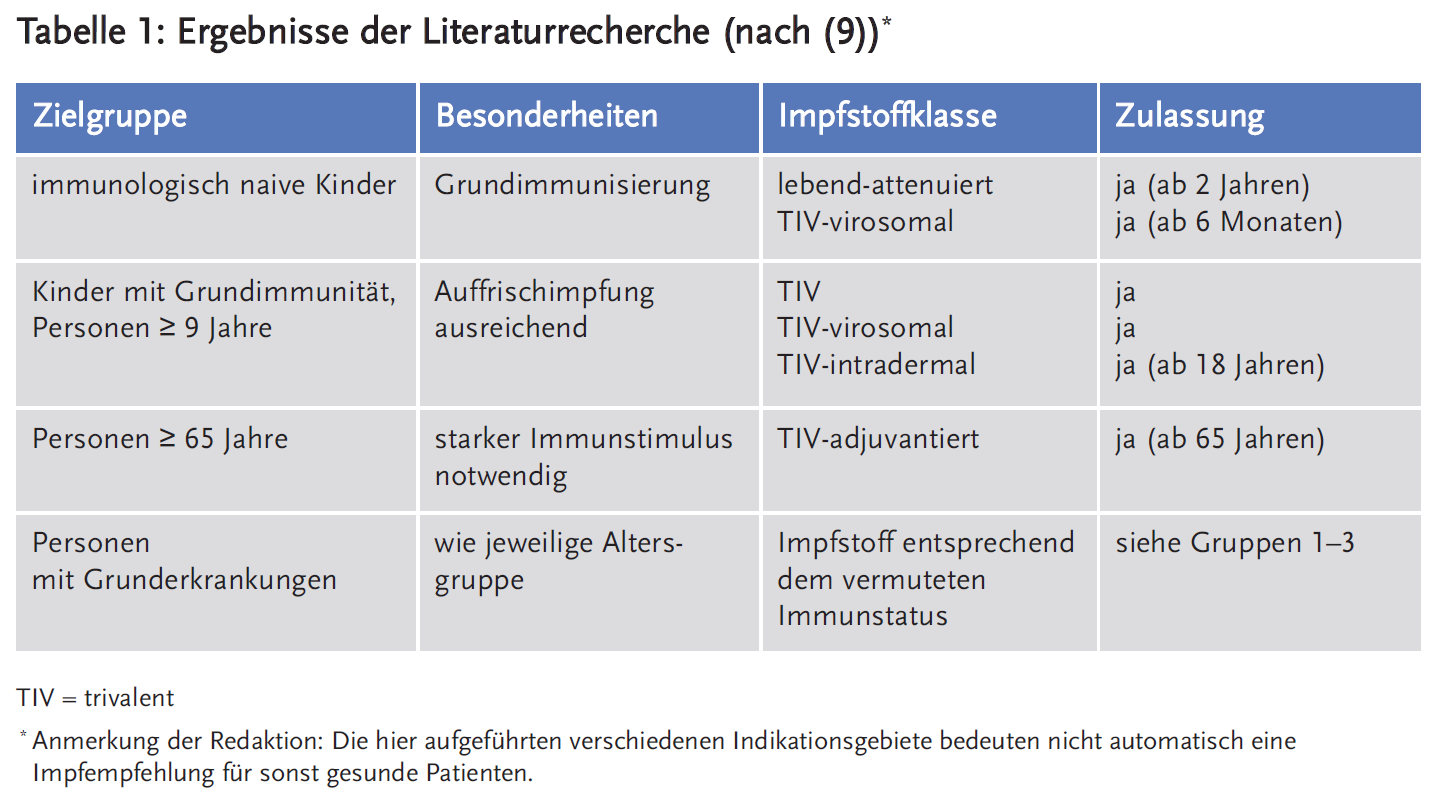
Im Ergebnis ihrer Literaturrecherche gelangen Wutzler et al. (9) zu einer differenzierten Betrachtung einzelner Influenzaimpfstoffe hinsichtlich ihrer Zusammensetzung und ihrer Wirksamkeit und Nebenwirkungen. Schlussfolgernd stellen sie in ihrer Publikation fest, dass es in der Praxis darum geht, für jede Zielgruppe die jeweils am besten geeigneten Influenzaimpfstoffe auszuwählen. Das Ergebnis ihrer Literaturrecherche haben sie tabellarisch zusammengefasst. Es ist in der Tabelle 1 abgewandelt wiedergegeben.
Neben der Schutzwirkung (Effektivität − effectiveness) sind bei der Bewertung der Influenzaimpfung auch Kosten-Nutzen-Überlegungen (Effizienz − efficiency) von Bedeutung. Influenzasaisons dauern in aller Regel zwischen November und April mehrere Wochen. Sie belasten die Volkswirtschaft jedes Jahr, wie der Bericht des RKI zur Influenzasaison 2012/2013 (9) mit etwa 3,4 Millionen Arbeitsunfähigkeiten zeigt. Kosten-Nutzen-Analysen liegen in der Literatur vor. Mit Hilfe von Modellrechnungen gelangen die Autoren (13-15) zu dem Schluss, dass Influenzaimpfungen bei guter Verträglichkeit nicht nur eine Abmilderung des Krankheitsverlaufs bei Geimpften, sondern mit einer Reduktion der epidemischen Ausbreitung der Influenzaviren auch eine günstige Kosten-Nutzen-Relation erzielen.
Akzeptanz und Umsetzung der Impfempfehlungen der Ständigen Impfkommission (STIKO) (16) sind in der Bundesrepublik allerdings mit ca. 40 % verbesserungswürdig (17).
Fazit
- Die Influenza ist eine epidemisch auftretende Virusinfektion. Senioren, chronisch Kranke, Säuglinge und Kleinkinder gelten als Risikogruppen. Außerdem geht eine Influenzaepidemie infolge zahlreicher Arbeitsunfähigkeiten mit beachtlichen volkswirtschaftlichen Einbußen einher.
- Influenzaimpfungen sind nebenwirkungsarm und bewirken in Studien eine Reduktion von Krankheitsschwere und Hospitalisierungen, ohne im Einzelfall eine Infektion sicher zu verhüten.
- Die Variabilität der Influenzaviren erfordert eine jährliche Anpassung des Impfstoffs an die Erregerstruktur der zirkulierenden Viren. Die Vielzahl zugelassener Influenzaimpfstoffe erfordert eine differenzierte Auswahl des für die jeweilige Zielgruppe geeigneten Impfstoffs.
- Mit dem Ziel einer Minimierung der Virusausbreitung ist bei allen Personengruppen, für die die STIKO eine Impfung empfiehlt, eine Impfquote von mindestens 70 % notwendig.
Interessenkonflikte
Ein Interessenkonflikt wird vom Autor verneint.
Literatur
- Diercke M, Benzler J, Schöneberg et al.: Falldefinitionen für die Surveillance meldepflichtiger Infektionskrankheiten in Deutschland, Ausgabe 2015. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 2014: 57: 1107-1110.
- Arbeitsgemeinschaft Influenza (AGI): Bericht zur Epidemiologie der Influenza in Deutschland Saison 2012/2013. Berlin: Robert Koch-Institut, 2013.
- Robert Koch-Institut (RKI): Aktualisierung der der Influenza zugeschriebenen Mortalität, bis einschließlich der Saison 2012/2013. Epidemiologisches Bulletin 2015; Nr. 3: 17-20.
- Mertens T: Influenzaimpfung: Das Ende der Einfachheit. Dtsch Arztebl Int 2013; 110: 791-792.
- Heininger U, Jilg W: Influenza (Grippe). In: Spiess H, Heininger U, Jilg W: Impfkompendium. Stuttgart, New York: Georg Thieme Verlag, 2012; 175-181.
- Grund S, Wichmann O, Mertens T, Hengel H.: Konzepte, Wirksamkeit und Perspektiven pandemischer und nichtpandemischer Influenzaimpfungen. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 2013; 56: 76-86.
- Jefferson T, Di Pietrantonj C, Al-Ansary LA et al.: Vaccines for preventing influenza in the elderly. Cochrane Database Syst Rev 2010; Issue 2: CD004876.
- Robert Koch-Institut (RKI): Influenzasurveillance der Arbeitsgemeinschaft Influenza: Rückblick auf starke saisonale Grippewelle im Winter 2008/09, Monitoring der Neuen Influenza im Sommer 2009 und Vorausschau auf die Saison 2009/10. Epidemiologisches Bulletin 2009; Nr. 42: 427-430.
- Wutzler P, Hardt R, Knuf M, Wahle K: Zielgruppenspezifische Wahl des Impfstoffs bei Grippeimpfung. Dtsch Arztebl Int 2013;110: 793-798.
- Mannino S, Villa M, Apolone G: Effectiveness of adjuvanted influenza vaccination in elderly subjects in northern Italy. Am J Epidemiol 2012; 176: 527-533.
- Salleras L, Domínguez A, Pumarola T et al.: Effectiveness of virosomal subunit influenza vaccine in preventing influenza-related illnesses and its social and economic consequences in children aged 3-14 years: a prospective cohort study. Vaccine 2006; 24: 6638-6642.
- Ambrose CS, Wu X, Knuf M, Wutzler P.: The efficacy of intranasal live attenuated influenza vaccine in children 2 through 17 years of age: a meta-analysis of 8 randomized controlled studies. Vaccine 2012; 30: 886-892.
- Kressin BW, Hallauer JF: Influenza: Ökonomische Bedeutung der Schutzimpfung. Dtsch Arztebl 1999; 96: A-342-343.
- Szucs T, Behrens M, Volmer T: Volkswirtschaftliche Kosten der Influenza 1996 – Eine Krankheitskostenstudie. Med. Klin 2001; 96: 63-70.
- Windorfer A, Ryan J, Zoellner Y: Ökonomische Bewertung von Grippeimpfungen am Arbeitsplatz in Deutschland. Arbeitsmed Sozialmed Umweltmed 2006; 41: 248-253.
- Mitteilung der Ständigen Impfkommission am Robert Koch-Institut (RKI): Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut/Stand: August 2014. Epidemiologisches Bulletin 2014; Nr. 34: 305-338.
- Poethko-Müller C, Schmitz R: Impfstatus von Erwachsenen in Deutschland – Ergebnisse der Studie zur Gesundheit Erwachsener in Deutschland (DEGS1). Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz 2013; 56: 845-857.
