Stellungnahmeverfahren zur frühen Nutzenbewertung von Arzneimitteln
Aufgaben der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ)
Einführung
Die Rahmenbedingungen für die Arzneimitteltherapie in Deutschland sind geprägt von ständig steigenden Kosten, einer Vielzahl von Regelungen bei der Bewertung und zur Verordnung von Arzneimitteln sowie einer unübersichtlichen Zahl von Arzneimittelinformationen. So haben sich im Jahr 2013 im Vergleich zum Vorjahr die Kosten für Arzneimittel im ambulanten Sektor um 3,2 Prozent auf eine Gesamtsumme von 32,11 Mrd. Euro erhöht.
Frühe Nutzenbewertung nach § 35a SGB V
Mit Wirkung zum 1. Januar 2011 ist das Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG) nach § 35a SGB V in Kraft getreten, es regelt u. a. die Preisbildung für neu zugelassene Arzneimittel. Der Gemeinsame Bundesausschuss (G-BA) legt anhand der frühen Nutzenbewertung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) den Zusatznutzen neu in den Markt eingeführter Arzneimittel fest. Bevor der G-BA einen Beschluss fasst, der Eingang in die Arzneimittel-Richtlinie nehmen wird und auf dessen Grundlage die Preisverhandlungen zwischen pharmazeutischem Hersteller und der GKV beginnen, wird ein Stellungnahmeverfahren (schriftlich und mündlich) durchgeführt. Die AkdÄ als Sachverständige der medizinischen Wissenschaft und Praxis wurde vom G-BA durch Beschluss als stellungnahmeberechtigte Organisation bestimmt (§ 92 Abs. 3a SGB V).
AkdÄ-Stellungnahmen und Bewertungen von Arzneimitteln
Die Aufgaben der AkdÄ sind in der Satzung festgelegt. Demnach fertigt die AkdÄ Stellungnahmen zu allen relevanten Themen an, die mit der Herstellung, Bezeichnung, Verteilung und Verwendung von Arzneimitteln und damit auch der Arzneimitteltherapie im Zusammenhang stehen. Das betrifft Einschätzungen zu deutschen und europäischen Gesetzesvorhaben (z. B. Arzneimittelgesetz, Arzneimittelverschreibungsverordnung, Richtlinien zur Pharmakovigilanz).
Als zur Stellungnahme berechtigte Organisation (gemäß § 92 Abs. 3a SGB V) beteiligt sich die AkdÄ am Verfahren der frühen Nutzenbewertung von Arzneimitteln. Mit der im Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG) vorgeschriebenen frühen Nutzenbewertung und den am Zusatznutzen orientierten Verhandlungen des Erstattungsbetrags zwischen dem GKV-Spitzenverband und pharmazeutischen Unternehmen (pU) hat der Gesetzgeber einen Paradigmenwechsel im Umgang mit neu in den Markt eingeführten Arzneimitteln eingeleitet.
So entscheidet der G-BA, ob ein nach dem 1. Januar 2011 neu in den Markt eingeführtes Arzneimittel einen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie für das Anwendungsgebiet besitzt. Wird ein solcher Zusatznutzen durch den G-BA festgestellt, folgt eine Vereinbarung über den Erstattungsbetrag zwischen dem GKV-Spitzenverband und pU, bei Nichteinigung entscheidet eine Schiedsstelle. Wenn kein Zusatznutzen festgestellt wird, kann das Arzneimittel in eine Festbetragsgruppe eingeordnet werden oder es wird ein Erstattungsbetrag zwischen dem GKV-Spitzenverband und pU ausgehandelt.
Die AkdÄ hat bisher 47 Stellungnahmen in der Nutzenbewertung abgegeben (siehe Tabelle 1).
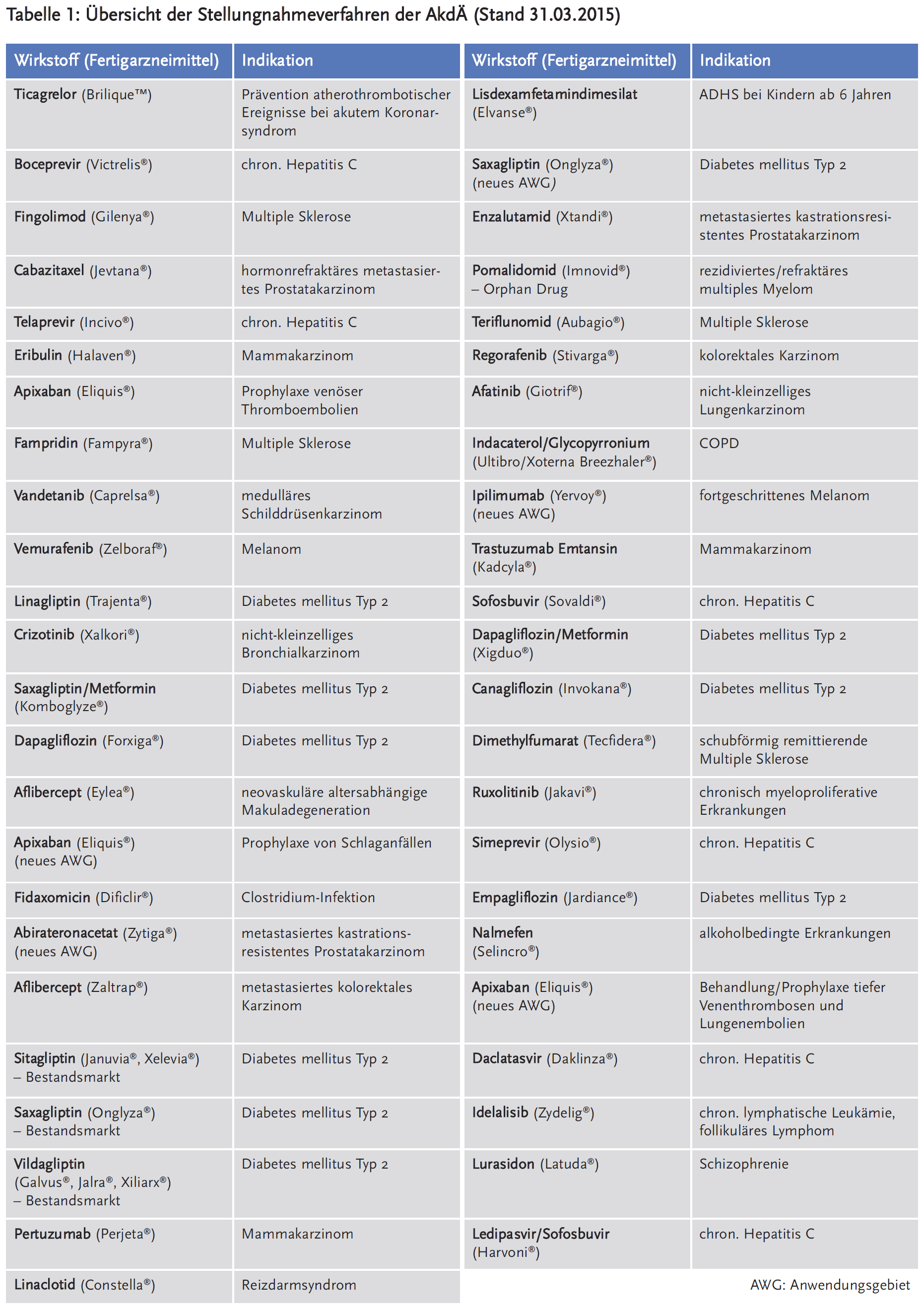
Die Stellungnahmen werden über den AkdÄ-Newsletter „AkdÄ News“ verteilt.
Die bisherigen Erfahrungen zeigen, dass weder ein neuartiges Wirkprinzip oder eine innovative biochemische Struktur noch der Nachweis der pharmakologischen Wirksamkeit und Sicherheit im Rahmen der Zulassung garantieren, dass durch diesen Wirkstoff auch ein überzeugender, patientenrelevanter Zusatznutzen und damit ein therapeutischer Fortschritt erreicht werden.
Die Meldung von unerwünschten Arzneimittelwirkungen (UAW) durch Ärzte an die AkdÄ („Spontanmeldungen“) ist seit den 1950er Jahren etabliert und in der ärztlichen Berufsordnung verankert. Meldungen zu UAW werden zu bereits seit Langem zugelassenen Arzneimitteln, vor allem aber auch zu neuen Arzneimitteln erfasst und bewertet. Dies fließt in die Beurteilung des therapeutischen Stellenwerts von Arzneimitteln ein.
Da zahlreiche Arzneimittel des Bestandsmarkts zu den umsatzstärksten gehören, ist die Entscheidung des Gesetzgebers, im Jahr 2014 die Nutzenbewertung des Bestandsmarkts wieder abzuschaffen, auf Unverständnis und Ablehnung in der Ärzteschaft gestoßen.
Nach einem Vortrag bei der Kammerversammlung der Ärztekammer Mecklenburg-Vorpommern am 8. November 2014 von Dr. med. Katrin Bräutigam, Geschäftsführerin der Arzneimittelkommission der deutschen Ärzteschaft.
