Neue orale Kontrazeptiva: Faktencheck
Rubrik: Arzneimittel – kritisch betrachtet
Die Anti-Baby-Pille: eine Erfolgsstory?
Im Jahr 2020 feierte die orale hormonelle Kontrazeption ihren 60. Geburtstag. In Deutschland wurde das erste orale Kontrazeptivum zur hormonalen Empfängnisverhütung am 1. Juni 1961 eingeführt – ein Jahr nach der Markteinführung in den Vereinigten Staaten. 63 Jahre später ist es unbestritten, dass hormonelle Kontrazeptiva einen medizinischen Fortschritt bedingt und zudem nicht nur die Gynäkologie und die Frauengesundheit, sondern auch die Gesellschaft wie kein anderes Arzneimittel geprägt haben.
Orale Kontrazeptiva sind heute in Europa das am häufigsten verwendete Verhütungsmittel und werden es voraussichtlich auch in der Zukunft bleiben, auch wenn insgesamt die Nutzung in allen Altersgruppen rückläufig ist, am deutlichsten bei den unter 30-Jährigen (1). Die Verordnungen hormoneller Kontrazeptiva für 15- bis 22-Jährige erfuhr in den vergangenen 20 Jahren einen Wandel. Wurden 2007 noch 332 Mio. Tagesdosen (DDD) verordnet, so waren es 2021 nur noch 312 Mio. DDD (1). Eine aktuelle Umfrage der Bundeszentrale für gesundheitliche Aufklärung (BZgA) zeigt, dass in Deutschland über 18-Jährige erstmals seit Jahren wieder häufiger mit Kondom als mit der Pille verhüten: 53 Prozent nutzen ein Kondom versus nur 38 Prozent die Pille. Im Jahr 2007 war es noch umgekehrt: Damals verhüteten 55 Prozent mit der Pille und 36 Prozent mit Kondom. Bereits 2018 hielten sich Pille und Kondom nahezu die Waage: 47 Prozent versus 46 Prozent. Als Grund für diesen Wandel wird vor allem eine zunehmend kritische Einstellung zu hormonellen Verhütungsmethoden angenommen. 61 Prozent der Frauen und Männer im Alter zwischen 18 und 49 Jahren gaben bei der Befragung an, dass hormonelle Verhütung „negative Auswirkungen auf Körper und Seele“ habe. 2018 wurde dies von 48 Prozent angegeben (2).
Wirksamkeit hormoneller Kontrazeptiva
Hormonelle Kontrazeption beschreibt die medikamentös ausgelöste, vorübergehende funktionale Sterilität durch die Gabe von weiblichen Sexualhormonen. Die kontrazeptive Wirkung beruht auf dem Zusammenwirken verschiedener Faktoren, wobei die Ovulationshemmung und Veränderungen der vaginalen Sekretion als die wichtigsten anzusehen sind. Hormonelle orale Kontrazeptiva sind, sofern sie bestimmungsgemäß angewendet werden, wirksam hinsichtlich der Verhütung einer Schwangerschaft. Als Maß für die Wirksamkeit gilt der sogenannte Pearl-Index.
Pearl-Index
Der Pearl-Index (benannt nach dem amerikanischen Wissenschaftler Raymond Pearl) ist das Beurteilungsmaß für die Sicherheit von Verhütungsmitteln: je kleiner der Pearl-Index, desto sicherer die Verhütungsmethode. Wenden 100 Frauen ein Jahr lang das gleiche Verhütungsmittel an und treten in diesem Zeitraum drei Schwangerschaften auf, so beträgt der Pearl-Index 3. Ein Pearl Index von 0,1 besagt, dass eine von 1000 Frauen, die ein Jahr lang das gleiche Verhütungsmittel anwenden, schwanger wird. Dabei sind die Angaben in der Literatur unterschiedlich. In der Fachinformation wird häufig der Pearl-Index angegeben, der sich auf die Verhütungssicherheit ohne Anwendungsfehler bezieht, die in Studien evaluiert wurde. Andere Angaben hingegen beziehen teilweise Anwendungsfehler mit ein. Die Angaben zum Pearl-Index können daher nur einen Anhaltspunkt ohne Anspruch auf allgemeine Gültigkeit geben.
Quelle: Wiegratz I, Thaler CJ. Hormonal contraception – what kind, when, and for whom? Dtsch Arztebl Int 2011; 108(28-29):495–505. doi: 10.3238/arztebl.2011.0495.
Verfügbare Präparate
Zur hormonellen Kontrazeption sind unterschiedliche Arzneimittel verfügbar:
- Östrogen-Gestagen-Kombinationspräparate als Einphasenpräparate (konstante Dosierung von Östrogenen und Gestagenen) oder Mehrphasenpräparate (wechselnde Dosierungen der Hormone im Verlauf des monatlichen Zyklus),
- reine Gestagenpräparate (Minipillen, Gestagen-only-Pillen, Progesteron-only-Pills (POP)).
Östrogene wirken kontrazeptiv, indem sie die Ausschüttung des Gonadotropin-Releasing-Hormons (GnRH) auf Hypothalamusebene und folglich die Sekretion von Follikelstimulierendem Hormon (FSH) in der Hypophyse vermindern. Dies führt zur Hemmung der Follikelreifung und der Ovulation. Auch Gestagene hemmen die Ovulation durch Suppression von GnRH und infolgedessen verminderte hypophysäre Sekretion von Luteinisierendem Hormon (LH). Zudem wirken sich Gestagene negativ auf die Nidationsbedingungen aus (Verdickung des Zervixsekrets, verminderte Tubenmotilität, Hemmung der Endometriumproliferation) (3).
Als Östrogen wird in den meisten hormonellen Kontrazeptiva Ethinylestradiol (EE) verwendet. Zudem sind Kontrazeptiva mit Estradiolvalerat und mit Estetrol verfügbar. Als Gestagenkomponente stehen zahlreiche synthetische Gestagene zur Verfügung, die durch ihre pharmakologischen Eigenschaften die nicht kontrazeptiven Effekte sowie die Sicherheit des Arzneimittels modulieren (3).
Sicherheit hormoneller Kontrazeptiva
Hormonale Kontrazeptiva beeinflussen zahlreiche physiologische Funktionen und können deshalb neben der gewünschten Kontrazeption weitere Effekte auslösen. Einige davon sind als vorteilhaft einzustufen und können therapeutisch genutzt werden, andere können schwerwiegende Nebenwirkungen bedingen, die ein gesundheitliches Risiko bedeuten können. Dies ist besonders relevant, da es sich es sich bei den Anwenderinnen hormoneller Kontrazeptiva in der Regel um gesunde junge Frauen handelt.
Bei Östrogen-Gestagen-Kombinationspräparaten (kombinierte orale Kontrazeptiva, KOK) sind die häufigsten in den Fachinformationen aufgeführten Nebenwirkungen Schwindel, Kopfschmerzen, Ödeme, Übelkeit, Brustspannen, Depressionen, Libidoveränderungen, Hautreaktionen und vaginale Beschwerden bzw. Infektionen. Besonders relevant ist das Risiko für schwerwiegende thromboembolische Ereignisse (3, 4). Die Anwendung hormoneller Kontrazeptiva ist mit einem erhöhten Risiko für venöse und arterielle Thromboembolien assoziiert.
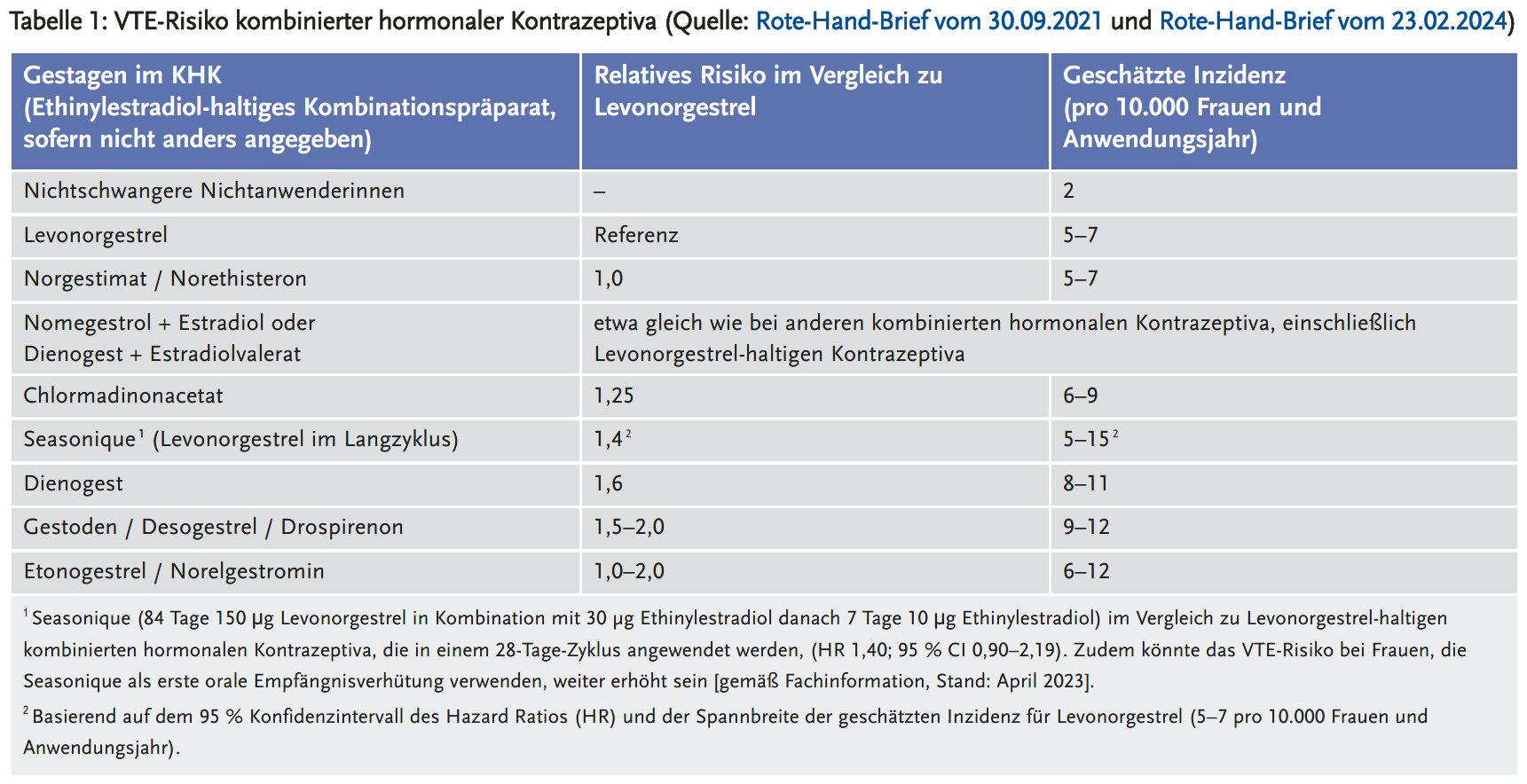
Venöse thromboembolische Ereignisse (VTE) wie tiefe Beinvenenthrombosen, Armvenenthrombosen, Hirnvenenthrombosen und Lungenarterienembolien sind seltene, aber schwerwiegende Ereignisse. Bei Frauen im gebärfähigen Alter ist das Risiko dafür insgesamt niedrig mit etwa 5 Ereignissen pro 10.000 Frauen pro Jahr (4). Bereits in den 1990er Jahren wurde bekannt, dass Kontrazeptiva ein erhöhtes VTE-Risiko bedingen. Das Risiko wird durch die Menge des Östrogens und die Art des verwendeten Gestagens moduliert. Nach einem Risikobewertungsverfahren gelangte der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittel-Agentur (EMA) 2014 zu dem Schluss, dass KOK mit den Gestagenen Levonorgestrel, Norethisteron und Norgestimat das niedrigste VTE-Risiko aufweisen (Tabelle 1). Am höchsten wurde das Risiko für KOK mit Drospirenon, Gestoden und Desogestrel eingestuft (5). Daraus resultierten zahlreiche risikominimierende Maßnahmen: Rote-Hand-Briefe, Änderungen der Produktinformation und die Einführung von Schulungsmaterial wie eine Informationskarte für die Patientinnen und eine Checkliste für die Verschreibung (6).
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) initiierte zudem eine Studie zur Überprüfung der Wirksamkeit der getroffenen risikominimierenden Maßnahmen. Die Ergebnisse dieser Studie zur Inzidenz von VTE in einer Kohorte von Neunutzerinnen im Alter bis 19 Jahren zeigten, dass die Verordnungen von KOK mit dem niedrigsten Risiko für VTE von 32 % in den Jahren 2005–2007 auf 54 % in den Jahren 2015–2017 angestiegen sind, während die Neuverordnungen von Kontrazeptiva mit einem erhöhten VTE-Risiko in den gleichen Zeiträumen von 46 % auf 33 % sanken. Um die Anwendung von Kontrazeptiva mit noch unbekanntem oder erhöhtem VTE-Risiko weiter zu reduzieren, hat das BfArM im September 2021 mit einem Rote-Hand-Brief an das unterschiedliche VTE-Risiko kombinierter hormoneller Kontrazeptiva erinnert (Tabelle 1) (7).
VTE-Risiko von Kontrazeptiva
Das VTE-Risiko von KOK mit einem Gestagen der dritten (Desogestrel oder Gestoden) oder vierten Generation (Drospirenon, Dienogest) ist doppelt so hoch wie bei Kontrazeptiva mit Gestagenen der zweiten Generation (Levonorgestrel, Norethisteron oder Norgestimat) (siehe Tabelle 1). Insgesamt ist das VTE-Risiko im ersten Jahr der Anwendung eines kombinierten hormonellen Kontrazeptivums bzw. nach einem erneuten Beginn der Anwendung (nach einer Anwendungspause von mindestens vier Wochen) am höchsten. Ebenfalls erhöht ist das Thromboembolierisiko bei Vorliegen von Risikofaktoren: Rauchen, Übergewicht (BMI über 30 kg/m2), Alter ab 35 Jahren, Immobilisierung und genetische Prädisposition.
Im Februar 2024 wurden die Ergebnisse der retrospektiven Studie RIVET-RCS (8) mit einem Rote-Hand-Brief kommuniziert (9). Die gepoolte Analyse basierte auf vier prospektiven, nichtinterventionellen Kohortenstudien, die 257.481 Anwenderinnen von Chlormadinon(CMA)- oder Levonorgestrel(LNG)-haltigen KOK einschlossen. Darunter waren 12.710 Frauen, die mit CMA 2 mg/Ethinylestradiol (EE) 30 μg behandelt wurden und 18.669 Frauen, die LNG 0,15 mg/EE 30 μg erhielten. Sie wurden insgesamt 25.457 Frauenjahre bzw. 33.710 Frauenjahre lang nachbeobachtet. Die Studien spiegelten die routinemäßige Anwendung von Verhütungsmitteln bei über 200.000 Frauen im reproduktiven Alter in zwölf europäischen Ländern sowie den USA/Kanada wider, da das Verordnungsverhalten der behandelnden Ärztinnen und Ärzte nicht beeinflusst wurde. Die Daten ermöglichen eine Abschätzung des VTE-Risikos mit einem bereinigten Hazard Ratio von 1,25 (95 % Konfidenzintervall [CI] 0,72–2,14) für das VTE-Risiko von CMA/EE im Vergleich zu LNG/EE. Aufgrund des Konfidenzintervalls konnte ein zweifach erhöhtes Risiko jedoch nicht ausgeschlossen werden. Auf der Grundlage dieser Ergebnisse wird das jährliche VTE-Risiko bei Frauen, die CMA/EE einnehmen, auf sechs bis neun VTE-Fälle pro 10.000 Frauen jährlich geschätzt. In einer weiteren, in Deutschland durchgeführten Studie (10) wurde ein noch höheres VTE-Risiko für CMA- gegenüber LNG-haltigen kombinierten oralen Kontrazeptiva festgestellt (bereinigtes Odds Ratio: 2,06; 95 % CI 1,58–2,68). Da zwischen den Studien relevante Unterschiede bestanden (z. B. das Alter der Patientinnen, die in der Studie erfassten Risikofaktoren und die Tatsache, dass ein Land im Vergleich zu mehreren Ländern beteiligt war), sind die Risikoabschätzungen beider Studien aus Sicht des BfArM möglicherweise nicht direkt vergleichbar. Jedoch kann aktuell ein zweifach erhöhtes VTE-Risiko unter CMA/EE gegenüber LNG/EE nicht ausgeschlossen werden.
Die Anwendung von Gestagenmonopräparaten erhöht das VTE-Risiko nicht entscheidend (4). Zu beachten ist allerdings, dass für Depot-Medoxyprogesteronacetat (sogenannte 3-Monatsspritze; DMPA) in einer Studie ein erhöhtes VTE-Risiko (3,6-fach im Vergleich zu Levonorgestrel) gefunden wurde (11).
Arterielle Thromboembolie (ATE)
Das Risiko für das Auftreten einer ATE, die z. B. zu einem Myokardinfarkt oder Schlaganfall führen kann, ist unter der Anwendung kombinierter hormoneller Kontrazeptiva ebenfalls erhöht. Die Datenlage lässt derzeit jedoch zumeist keine Rückschlüsse auf Unterschiede im ATE-Risiko zwischen den einzelnen Kontrazeptiva zu (4).
Immer mehr neue Kontrazeptiva auf dem Markt
In den vergangenen sechs Jahrzehnten wurden immer neuere Gestagene und auch Östrogene entwickelt, die die hormonelle Kontrazeption sicherer bzw. verträglicher machen sollten. Manche dieser vermeintlichen Innovationen entpuppten sich allerdings schnell als risikoreicher als bereits etablierte Wirkstoffe entgegen der intensiven Bewerbung durch die Zulassungsinhaber als neue „Wundermittel“ mit „nicht kontrazeptiven Benefits“ wie schönere Haut und keine Gewichtszunahme (12). So wurde das Gestagen Drospirenon (DRSP) bei der Markteinführung im Jahr 2000 medienwirksam als „Schönheitspille“ beworben, die neben „zuverlässiger Verhütung“ sogar die „Möglichkeit zur Gewichtsabnahme" bietet (13). Einige Jahre später stand allerdings fest, dass DRSP ein deutlich höheres VTE-Risiko im Vergleich zu älteren Gestagenen birgt (14). Dass das Risiko zu diesem Zeitpunkt bekannt war, aber nicht in der Produktinformation DRSP-haltiger Kontrazeptiva dargestellt war, kostete den Zulassungsinhaber etwa zwei Milliarden USD allein für Vergleichszahlungen in den USA für Erkrankungen infolge von VTE und Lungenembolien (15).
Die DRSP-Entwicklung ist ein deutliches Beispiel dafür, dass neue Kontrazeptiva nicht per se Vorteile bringen und sogar ein nachteiliges Sicherheitsprofil aufweisen können. Seltene und sehr seltene Risiken sind bei der erstmaligen Zulassung neuartiger Arzneimittel nicht bekannt und können erst nach der Markteinführung zuverlässig identifiziert werden. Umso wichtiger ist es im Sinne der Patientinnensicherheit, besonders kritisch auf Neueinführungen im Bereich der Kontrazeptiva zu schauen und die Werbeaussagen zu prüfen. Angesicht der Risiken DRSP-haltiger Kontrazeptiva war es verwunderlich, dass 2021 zwei neue orale Kontrazeptiva mit diesem Gestagen eingeführt wurden: ein DRSP-Monopräparat (Minipille, Drospirenon-only-Pille) und ein Kombinationspräparat mit einem neuartigen Östrogen Estetrol und DRSP.
Die Drospirenon-only-Pille
Im Mai 2021 wurde das neue DRSP-Monopräparat in Deutschland eingeführt. Jeder Monatsblister besteht aus 24 weißen Tabletten á 4 mg DRSP und vier grünen Placebotabletten. Das neue Kontrazeptivum wurde sofort in Fachkreismedien als innovativ und einzigartig beworben, mit hoher kardiovaskulärer Sicherheit und nahezu für jede Frau geeignet: Frauen über 35 Jahre, Raucherinnen, Übergewichtige, Adoleszente und Stillende (16, 17).
Wirksamkeit
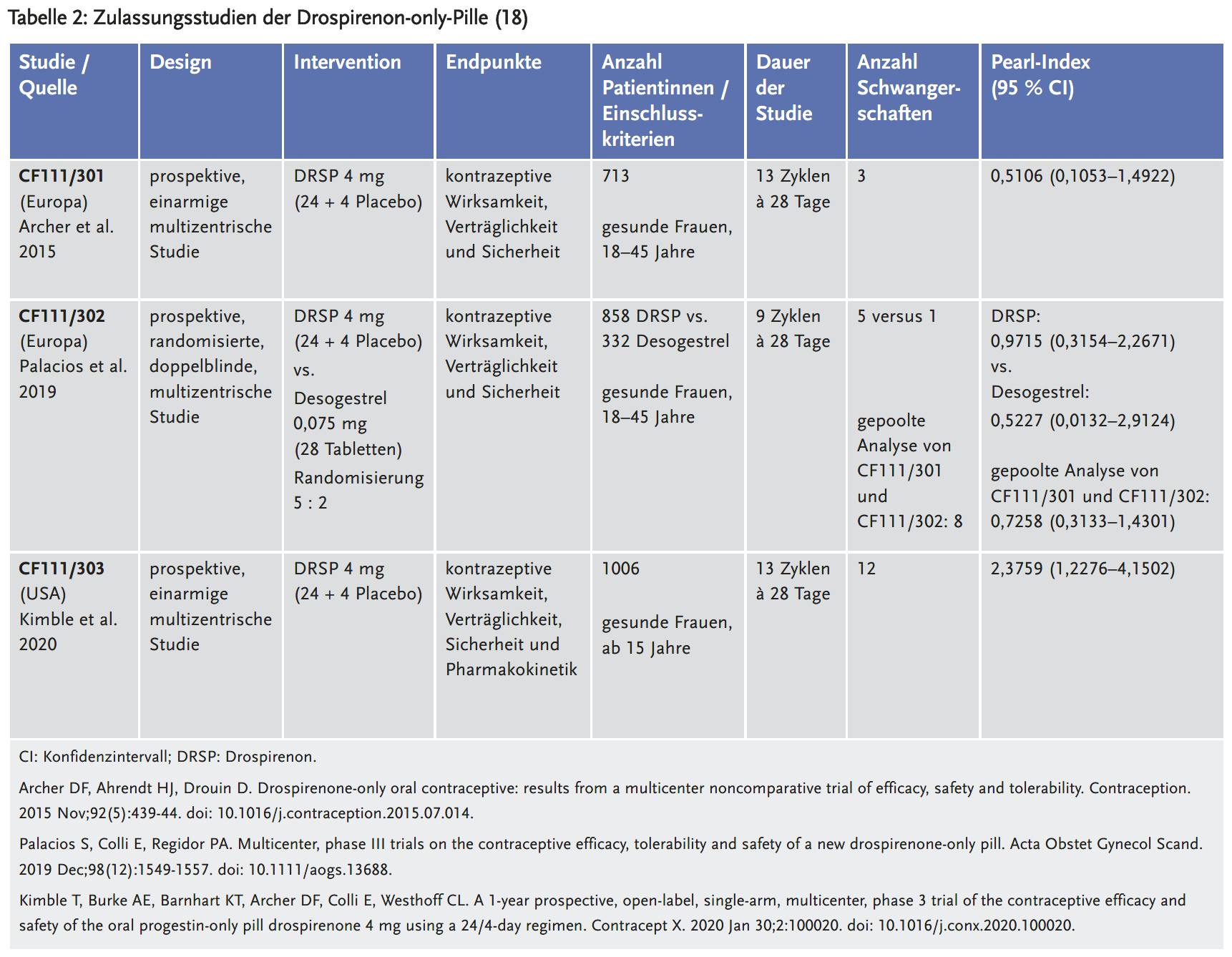
Die DRSP-only-Pille wurde auf Basis von drei pivotalen Phase-III-Studien in der EU zugelassen (18), die in Tabelle 2 dargestellt sind. Die kontrazeptive Sicherheit wurde anhand des Pearl-Index erhoben: 0,51–2,38. In einer Pressemitteilung wurde das Kontrazeptivum mit dem Pearl-Index von 0,73 aus der gepoolten Analyse der Studien CF111/301 und CF111/302 beworben (17). Diese Analyse war präspezifiziert, allerdings war der Pearl-Index in der einzigen doppelblinden, randomisierten, kontrollierten Studie (RCT) etwa doppelt so hoch wie in der offenen einarmigen Studie. Es fand sich keine Erklärung für diesen Unterschied, abgesehen vom Studiendesign (offen vs. doppelblind, einarmig vs. RCT). Da sich allerdings die Grundcharakteristika der eingeschlossenen Patientinnen nicht unterschieden, wurde die gepoolte Analyse von der EMA akzeptiert (18). Der hohe Pearl-Index in der USA-Studie (CF111/303) wurde mit dem deutlich höheren BMI der Patientinnen sowie mit soziodemografischen Faktoren wie niedriges Einkommen, niedrige Bildung und hispanische Abstammung erklärt, die in Verhütungsstudien mit einer geringen Compliance assoziiert sind.
Zykluskontrolle und Blutungsmuster
Aufgrund des 24/4-Schemas wird die neue DRSP-Monopille mit einem vorteilhaften Blutungsmuster sowie guter Zykluskontrolle beworben (17).
Zykluskontrolle
Andere Gestagen-Monokontrazeptiva enthalten 28 wirkstoffhaltige Tabletten und werden ohne Pause kontinuierlich eingenommen. Die Rationale hinter dem 24/4-Schema der Gestagen-Monoprärats mit DRSP, das vier hormonfreie Tage in jedem Zyklus vorsieht, ist die Schaffung einer reinen Gestagen-Methode, die vorhersehbare Abbruchblutungen bietet. Damit es jedoch zu einer Entzugsblutung kommt, muss ein gewisses Maß an östrogenbedingter Proliferation der Gebärmutterschleimhaut vorhanden sein. Dies ist auch der Grund für den Zusatz von Östrogen in hormonellen Kontrazeptiva: die Proliferation der Gebärmutterschleimhaut anzuregen, um anschließend durch das Absinken des Hormonspiegels die Ablösung des Endometriums und eine Blutung zu ermöglichen. Aufgrund des Fehlens der Östrogenkomponente ist während der Anwendung der DRSP-Monopille im 24/4-Schema kein vorhersehbares Blutungsmuster zu erwarten.
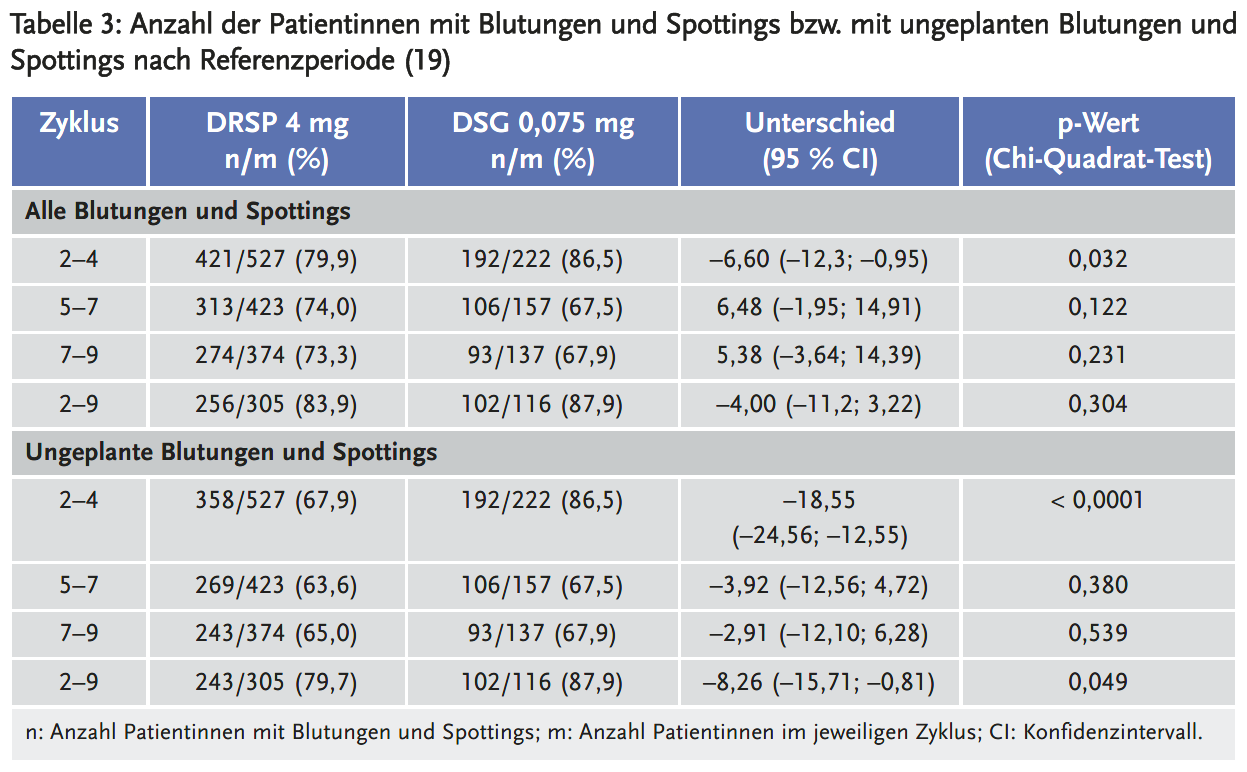
Bei Betrachtung des Blutungsmusters über der kompletten Laufzeit der Studie zeichnet sich allerdings ein differenzierteres Bild ab. Dabei wurde der Anteil der Patientinnen mit geplanten und ungeplanten Blutungen unter DRSP und Desogestrel (DSG) verglichen. Geplante Blutungen wurden nur unter DRSP erwartet, da im DSG-Regime die Einnahme ohne hormonfreie Pause erfolgt. Besonders relevant ist daher die Inzidenz ungeplanter Blutungen/Spottings (Tabelle 3) (17). Das Auftreten einer Entzugsblutung (siehe Hinweis am Seitenrand) war in den ersten Zyklen am höchsten und nahm mit jedem weiteren Zyklus ab. Nach neunmonatiger Anwendung wurde eine Entzugsblutung bei weniger als 20 % der Anwenderinnen unter DRSP berichtet.
Ungeplante Blutung
Als ungeplante Blutung bzw. Spotting war jede Blutung/Spotting definiert, die während der Einnahme der hormonhaltigen Tabletten (Tage 2 bis 23) auftrat und keine geplante Blutung darstellte. Die Entzugsblutung („geplante Blututng“) war definiert als eine Blutung, die während der vier hormonfreien Tage beginnt und bis zu acht aufeinanderfolgende Tage andauert.
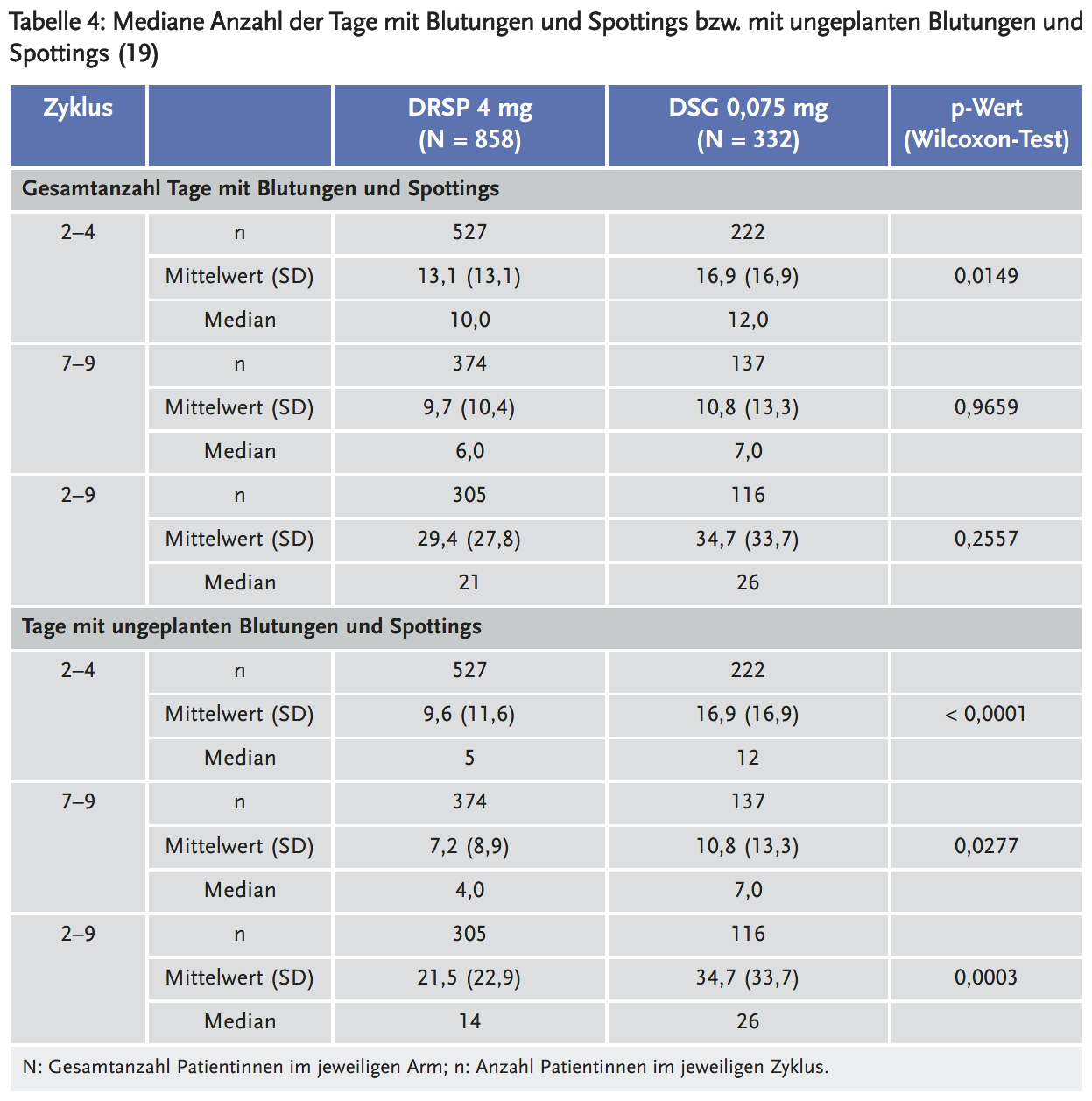
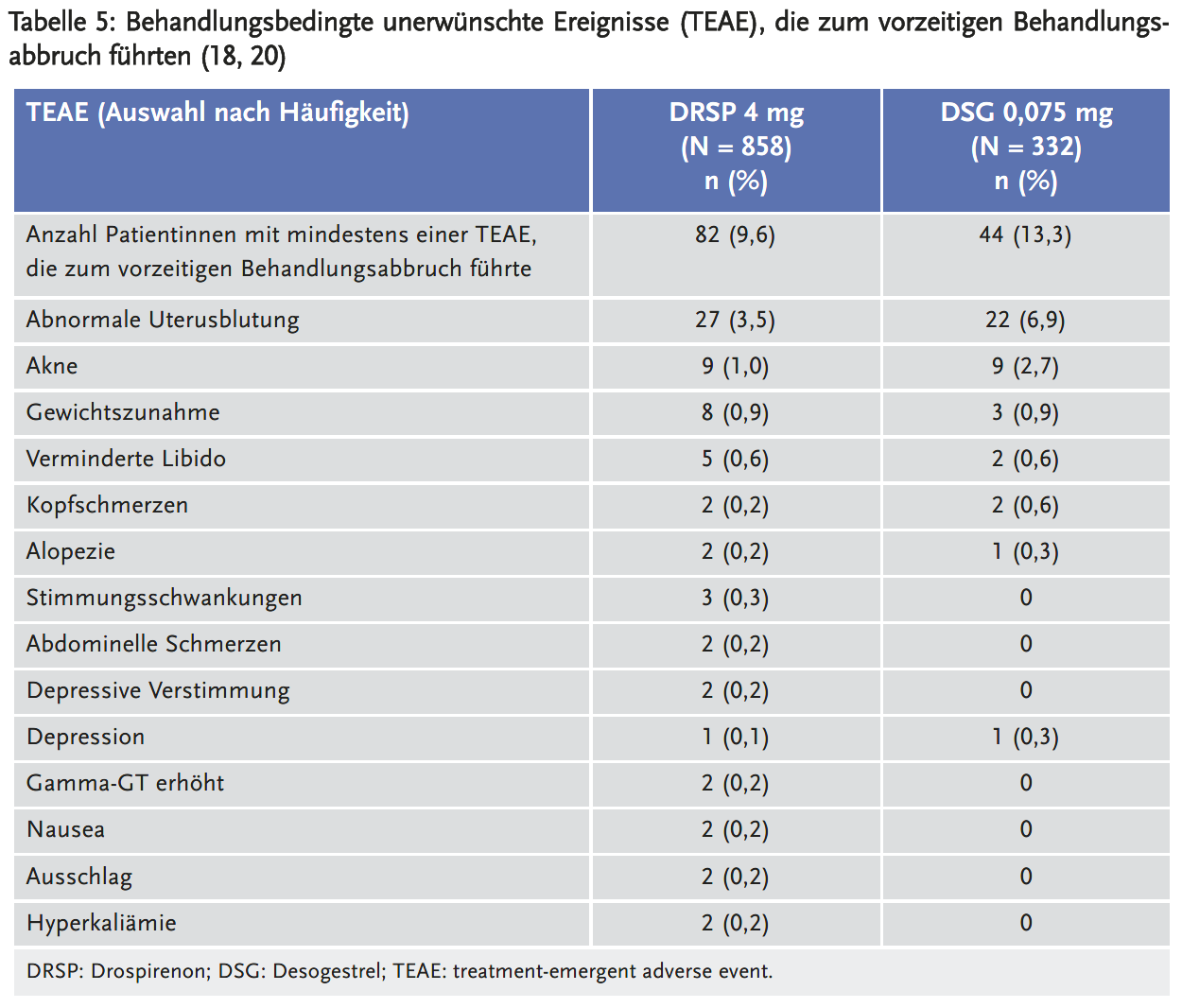
Die durchschnittliche Gesamtanzahl der Blutungstage verringerte sich von 13,1 Tagen in den Zyklen 2–4 auf 9,7 Tage in den Zyklen 7–9 unter DRSP gegenüber 16,9 auf 10,8 Tage unter DSG (Tabelle 4). Der Anteil der Probandinnen ohne Blutungen/Spottings während der Zyklen 2–4 betrug 20,1 % für DRSP und 13,5 % für DSG und stieg in den Zyklen 7–9 auf 26,7 % unter DRSP und auf 32,1 % unter DSG an (18). Die Anzahl der Probandinnen mit einer verlängerten Blutung, definiert als eine Blutung, die länger als zehn aufeinanderfolgende Tage andauert, betrug unter DRSP 18,1 % vs. 26,1 % unter Desogestrel während der Zyklen 2–4 und 9,1 % vs. 16,7 % während der Zyklen 7–9. Die Abbruchrate aufgrund von blutungsbedingten unerwünschten Ereignissen betrug 3,5 % unter DRSP und 6,9 % unter DSG (Tabelle 5).
Zusammenfassend kam es in den ersten fünf Zyklen unter DRSP nummerisch zu insgesamt weniger Blutungen als unter DSG. Der Unterschied war abgesehen vom Zyklus 5 nicht statistisch signifikant (19). Ab Zyklus 6 war die Anzahl der Patientinnen mit Blutungen und Spottings unter DSG sogar nummerisch geringer als unter DRSP. Mit jedem weiteren Zyklus nahm die Gesamtinzidenz der Blutungen und Spottings in beiden Armen ab. Im 9. Zyklus hatten 56,3 % der Frauen Blutungen und Spottings unter DRSP vs. 45,3 % unter Desogestrel (Unterschied 10,99 Prozentpunkte; 95 % CI 20,2–19,97; p = 0,017) (19). Ungeplante Blutungen/Spottings traten unter DSG in allen Zyklen nummerisch häufiger auf als unter DRSP, der Unterschied war aber ab Zyklus 7 nicht mehr statistisch signifikant (19).
Somit zeigt der Vergleich zwischen DRSP und DSG nur sehr geringe, statistisch nicht signifikante Unterschiede bezüglich des Blutungsmusters nach neun Zyklen. Im Public Assessment Report wird ausgeführt, dass die Anzahl der beobachteten Patientinnen mit verfügbaren Daten zu Blutungen/Spottings pro Zyklus von etwa 90 % im ersten Zyklus auf etwa 50 % im 9. Zyklus abnahm, sodass die verfügbaren Daten keine robusten Schlussfolgerungen über die Veränderung des Blutungsmusters im Laufe der Zeit erlauben (18).
Sicherheit
Für die Evaluation der Sicherheit wurden die Ergebnisse von sechs Phase-II- und vier Phase-III-Studien mit insgesamt 2700 Patientinnen zusammengefasst (18). Behandlungsbedingte unerwünschte Ereignisse (TEAE) traten bei 50,6 % der Frauen unter DRSP und 45,0 % der Frauen unter DSG auf. Die häufigsten TEAE waren Rhinopharyngitis (5,2 % unter DRSP vs. 3,9 % unter DSG), Kopfschmerzen (5,2 % vs. 5,1 %), Akne (4,3 % vs. 5,7 %), Metrorrhagie (2,9 % vs. 2,1 %), Nausea (2,9 % vs. 0,3 %), Brustschmerzen (2,8 % vs. 1,5 %), Gewichtszunahme (2,7 % vs. 1,8 %), Dysmenorrhoe (2,6 % vs. 0,6 %) and zervikale Dysplasie (2,5 % vs. 3,3 %).
Schwere TEAE traten in den Langzeitstudien bei 3,9 % unter DRSP vs. 3,3 % unter DSG auf; die häufigsten darunter waren: Dysmenorrhoe, Brustschmerzen, abdominelle Schmerzen und Kopfschmerzen, wobei die Inzidenz in beiden Armen vergleichbar war. Die häufigsten schwerwiegenden unerwünschten Ereignisse in den Langzeitstudien unter DRSP waren: Hyperkaliämie (n = 5; 0,2 %), Appendizitis (n = 4; 0,1 %), Fibroadenom der Brüste, zervikale Dysplasie, Implantation einer Brustprothese und Cholelithiasis (jeweils n = 2; 0,1 %) sowie erhöhtes Serumkalium (n = 1; < 0,1 %). Unter DSG trat kein schwerwiegendes unerwünschtes Ereignis bei mehr als einer Patientin auf. Hyperkaliämie wurde als schwerwiegendes unerwünschtes Ereignis bei fünf Patientinnen unter DRSP berichtet. Die erste Erhöhung des Serumkaliums manifestierte sich dabei zu unterschiedlichen Zeitpunkten zwischen drei Wochen nach Beginn der Einnahme und 2,5 Monaten nach Beendigung der Einnahme. Eine der Patientinnen mit Hyperkaliämie hatte Tachykardie, bei den anderen trat keine klinische Symptomatik auf. TEAE, die zum vorzeitigen Behandlungsabbruch führten, sind in Tabelle 5 dargestellt (20).
Die Drop-out-Rate war unter DSG (13,3 %) statistisch signifikant höher als unter DRSP (9,6 %). Die häufigsten Gründe dafür waren blutungsbezogene unerwünschte Ereignisse (6,9 % vs. 3,5 %) sowie Akne (2,7 % vs. 1,0 %). Unter DRSP brachen mehr Frauen vorzeitig die Studie im Vergleich zum DSG aufgrund von Stimmungsschwankungen, abdominellen Schmerzen und depressiver Verstimmung ab (20).
Laut Risk Management Plan wurden für die DRSP-Monopille als relevante potenzielle Risiken VTE, Knochenfrakturen/Reduktion der Knochenmineraldichte, Leberfunktionsstörungen, gutartige und bösartige Lebertumore, extrauterine Schwangerschaft und Brustkrebs definiert. Der Zulassungsinhaber wurde verpflichtet, eine Post Authorisation Safety Study (PASS) nach der Zulassung durchzuführen, um das VTE-Risiko zu überwachen und mit dem Risiko anderer Kontrazeptiva zu vergleichen (18).
Gutes Sicherheitsprofil
Der DRSP-Monopille wird ein gutes Sicherheitsprofil zugesprochen, weil „über das gesamte klinische Entwicklungsprogramm hinweg (> 20.000 Zyklen) keine einzige venöse Thromboembolie (VTE) auftrat“ (16). Letzteres ist richtig, lässt allerdings nicht die Schlussfolgerung zu, dass sich daraus ein gutes Sicherheitsprofil ableiten lässt. 20.000 Zyklen entsprechen etwa 1538 nach den Einschlusskriterien selektierten Studienteilnehmerinnen, die ein Jahr lang unter Studienbedingungen mit diesem Arzneimittel verhütet haben. Setzt man dies in Relation zum VTE-Risiko von DRSP-haltigen KOK mit Ethinylestradiol – 9–12 Fälle pro 10.000 Frauen pro Anwendungsjahr – ist schnell ersichtlich, dass die Anzahl der Studienteilnehmerinnen nicht ausreicht, um das VTE-Risiko des neuen Kontrazeptivum abschließend bewerten zu können.
In der EudraVigilance-Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen (21) finden sich zu DRSP (als Monopräparat) 22 Meldungen von TVT, 4 Meldungen von venösen Embolien, 7 Meldungen von venösen Thrombosen und 6 Meldungen von Thrombosen (Stand: 05.07.2024). Grundsätzlich lassen diese Zahlen keine Aussage über die tatsächliche Inzidenz der jeweiligen Nebenwirkung und einen möglichen kausalen Zusammenhang mit dem Arzneimittel zu, zumindest nicht ohne weitergehende Daten und wissenschaftliche Analysen.
Neue Kombinationspille: Estetrol + Drospirenon
Estetrol wird während der Schwangerschaft in der fetalen Leber des Fetus gebildet und ist ab der neunten Schwangerschaftswoche im maternalen Blut nachweisbar. Seine physiologische Funktion während der Schwangerschaft ist allerdings noch unklar. Strukturell ist Estetrol den natürlichen Östrogenen Estron, Estradiol und Estriol sehr ähnlich. Estetrol hat einen einfachen Stoffwechselweg und wirkt selektiv in verschiedenen Geweben. Das niedrig potente Östrogen bindet im Gegensatz zu den meisten Östrogenen nicht mit hoher Affinität an das Plasma-Sexualhormon-bindende Globulin (SHBG) und wird nicht über das Cytochrom P450 (CYP) metabolisiert – es zeigt daher nur begrenzte Auswirkungen auf die CYP-Enzyme (23, 24). In den Medien wurde Estetrol als „natürliches Östrogen“, „pflanzlich hergestelltes Östrogen“, „pflanzliches Estetrol“ und „E4: an answer from nature“ bezeichnet (25, 26).
Das neue kombinierte Kontrazeptivum enthält 24 rosa Tabletten mit 14,2 mg Estetrol und 3 mg DRSP sowie vier weiße Placebotabletten. In den Fachkreisen wird es als eine „einzigartige Wirkstoffkombination“ und „Innovation“ beworben. Das neue Präparat soll „vielversprechende Hinweise auf geringere Effekte auf Leber- und Hämostaseparameter und auf sehr gute Zyklusstabilität“ haben. Zudem sollen die Anwenderinnen von den nicht kontrazeptiven Benefits von DRSP profitieren: also von seinen antiandrogenen und antimineralkortikoiden Effekten (27).
Zulassung
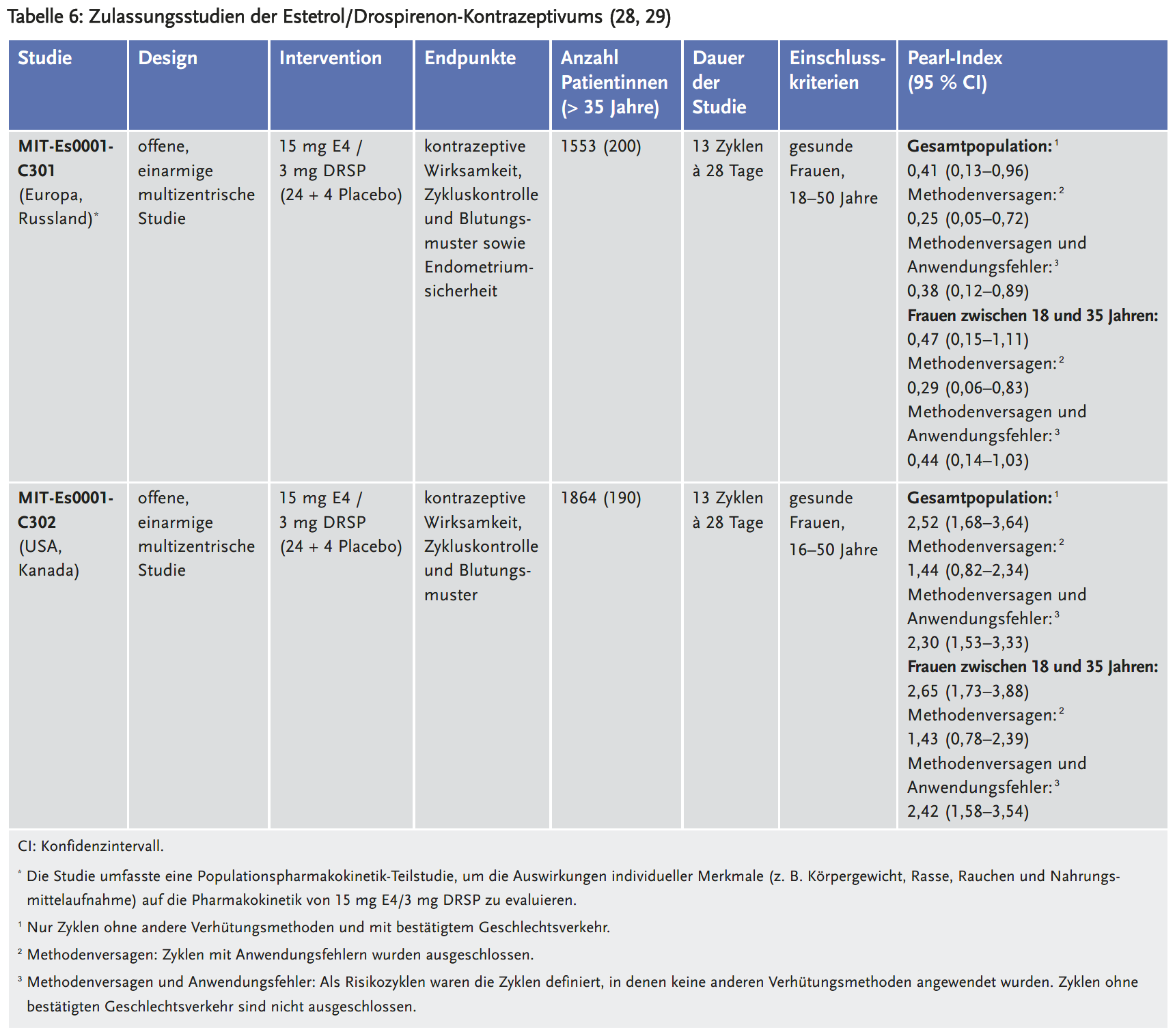
Für die Zulassung wurden zwei multizentrische, offene, einarmige Phase-III-Studien vorgelegt, die in Europa und Russland (28) bzw. den USA und Kanada (29) durchgeführt wurden. Eingeschlossen wurden Frauen zwischen 18 und 50 Jahren (Europa/Russland) bzw. 16 und 50 Jahren (USA/Kanada). Die Studiendauer betrug 13 Zyklen. Primärer Endpunkt war die kontrazeptive Wirksamkeit anhand des Pearl-Index; als sekundäre Endpunkte wurden die Zykluskontrolle und das Blutungsmuster evaluiert (Tabelle 6).
Die Mehrheit der in die Studie C301 (Europa, Russland) eingeschlossenen Frauen war 35 Jahre oder jünger (12,9 % waren > 35 Jahre), weiß (98,6 %), Nichtraucherinnen (84 %) mit einem BMI < 30 kg/ m2 (94 %). Etwa zwei Drittel (61 %) wechselten von einem anderen hormonellen Verhütungsmittel, das sie innerhalb der letzten drei Monate verwendet hatten. 39 % wurden als Neuanwenderinnen eingestuft, weil sie in den drei Monaten vor der ersten Dosis des Prüfpräparats keine hormonellen Verhütungsmittel nutzten, 25 % der Probandinnen hatten noch nie eine hormonelle Empfängnisverhütung verwendet. Die Ausschlusskriterien spiegelten die allgemeinen Kontraindikationen für hormonelle Verhütung wider, z. B. in Bezug auf Risiken für venöse Thromboembolien, Bluthochdruck, Diabetes und Leberanomalien.
Zykluskontrolle und Blutungsmuster
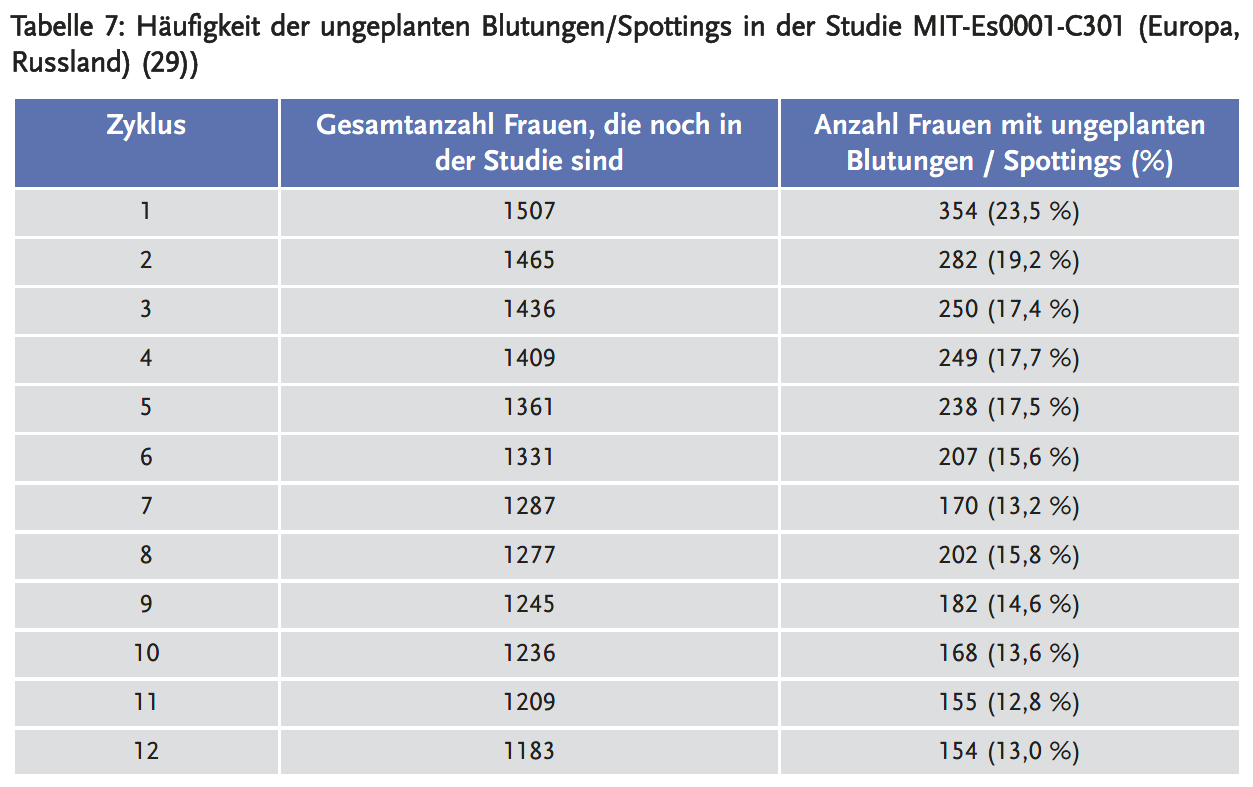
Die Häufigkeit geplanter Blutungen betrug 91,9–94,4 % pro Zyklus. Die mittlere Anzahl der Tage mit geplanten Blutungen lag bei 4,7 bis 6,1 pro Zyklus. Im Zyklus 1 hatten 23,5 % der Frauen ungeplante Blutungen/Spottings. Die Inzidenz der ungeplanten Blutungen und Spottings nahm mit jedem weiteren Zyklus kontinuierlich ab (Tabelle 7), sodass nach 12 Zyklen etwa 13 % der Frauen ungeplante Blutungen und Spottings hatten. Die durchschnittliche Anzahl der Tage mit ungeplanten Blutungen und/oder Schmierblutung über die Zyklen 2–12 betrug zwischen 3,4 und 3,9 Tagen pro Zyklus. Etwa 5,6–8,1 % der Frauen hatten gar keine Blutung pro Zyklus.
Sicherheit
In der nordamerikanischen Studie traten TEAE bei 61,0 % der Probandinnen auf. Schwerwiegende TEAE wurden bei 1,7 % (17 Frauen) berichtet. Diese klangen bis auf zwei Fälle ohne Folgeerscheinungen ab. Eine Frau erlitt eine Aneurismenruptur mit neurologischen Folgen. Bei einer Frau mit Hyperkaliämie war der Ausgang unbekannt. 113 Frauen (11,2 %) brachen die Studie vorzeitig ab, 100 (9,9 %) davon wiesen mindestens ein potenziell damit zusammenhängendes unerwünschtes Ereignis auf. Es wurden keine Fälle von VTE berichtet. Die Häufigkeit von Hyperkaliämie war niedrig: 5 Frauen (0,5 %) hatten eine asymptomatische Hyperkaliämie, die vom Prüfarzt als leicht eingestuft wurde und in keinem der Fälle zu Hospitalisierung führte.
In der europäischen Studie (Europa, Russland) traten TEAE bei 28,5 % der Frauen auf. Die Mehrzahl (63 %) war nicht schwer oder schwerwiegend. Die häufigsten TEAE waren Metrorrhagie (5,0 %), vaginale Blutungen (4,3 %), Akne (3,8 %) und Kopfschmerzen (2,8 %). 9,1 % der Frauen brachen die Studie vorzeitig ab aufgrund von TEAE; die häufigsten darunter waren Metrorrhagie (1,5 %), Akne (1,3 %) und vaginale Blutungen (1,0 %). Schwerwiegende TEAE wurden bei 13 Frauen (0,8 %) gemeldet, von denen nur eine VTE der unteren Extremitäten als behandlungsbedingt eingestuft wurde. Die VTE trat während des vierten Behandlungszyklus bei einer 32-jährigen weißen Frau mit einem BMI von 21,5 kg/m2 auf, die in der Vergangenheit hormonell verhütet hatte (mehr als drei Monate vor der Aufnahme in die Studie). Sie hatte vor der Studieneintritt drei Jahre lang Escitalopram eingenommen und hatte keine anderen bekannten prädisponierenden Risikofaktoren. Nach Absetzen der Kontrazeption und antithrombotischer Behandlung kam es zu keinen Folgeerscheinungen.
Das VTE-Risiko unter der Kombination Estetrol/DRSP ist derzeit nicht abschließend zu bewerten. Deswegen wurde ein Hinweis in die Produktinformation aufgenommen, dass es bisher nicht bekannt ist, wie das Risiko im Vergleich zu KOK einzuordnen ist, die niedrig dosiertes Ethinylestradiol (< 50 μg) in Kombination mit Levonorgestrel, Norgestimat oder Norethisteron enthalten. Zudem wurde für Estetrol/DRSP auch eine Post-Marketing-Sicherheitsstudie beauflagt, deren Ergebnisse allerdings erst im Jahr 2029 erwartet werden (30).
In der EudraVigilance-Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen (21) finden sich zu Estetrol/DRSP fünf Meldungen von TVT und neun Meldungen von weiteren Thrombosen (Stand: 05.07.2024).
Verordnung hormoneller Kontrazeptiva
Das niedrige Risiko für VTE (tiefe Beinvenenthrombosen, Armvenenthrombosen, Hirnvenenthrombosen und Lungenarterienembolien) bei nicht schwangeren Frauen im gebärfähigen Alter (etwa zwei pro 10.000 Frauen und Anwendungsjahr) wird insbesondere durch hormonelle KOK (je nach Konzentration des Östrogens und Art des Gestagens) deutlich erhöht. Daher muss das individuelle VTE-Risiko jeder Patientin in die Beratung zur Auswahl geeigneter Kontrazeptionsmethoden einbezogen werden (4). Für nicht orale kombinierte hormonelle Kontrazeptiva (z. B. Vaginalring, Kontrazeptionspflaster) konnte ebenfalls ein erhöhtes VTE-Risiko belegt werden (7). Die Anwendung von Gestagen-Monopräparaten mit Levonorgestrel oder Desogestrel erhöht das VTE-Risiko nicht entscheidend; für das Depot-Medoxyprogesteronacetat (sogenannte 3-Monatsspritze; DMPA) wurde in einer Studie ein erhöhtes VTE-Risiko gefunden (4). Für die DRSP-only-Pille liegen derzeit keine ausreichenden Langzeitdaten vor, die eine abschließende Bewertung erlauben würden.
Zur individuellen Abschätzung des VTE-Risikos ist laut S3-Leitlinie „Hormonelle Empfängnisverhütung“ (4) ein Screening auf Thrombophilie-Laborparameter nur sehr eingeschränkt hilfreich. Eine routinemäßige Durchführung von Thrombophilietestungen vor Verschreibung von Kontrazeptiva wird daher nicht empfohlen. Die Eigen- und Familienanamnese sowie konstitutionelle und dispositionelle Risikofaktoren müssen in die Beratung einbezogen werden, weil sie von großer Relevanz sind für die individuelle Abschätzung des VTE-Risikos im Rahmen einer Verordnung von Kontrazeptiva.
Dafür sind mindestens die folgenden Angaben zu erheben:
- Lebensalter
- Body-Mass-Index
- Rauchen (inklusive mittlerer Zigarettenkonsum pro Tag)
- bestehende bzw. absehbare Immobilität bzw. geplante große Operationen
- Eigenanamnese für VTE (inklusive potenzieller Auslöser zur Erkennung hormonassoziierter und unprovozierter Ereignisse)
- Familienanamnese für VTE (insbesondere Verwandte ersten Grades relevant; wobei sowohl das Lebensalter bei Auftreten der VTE, die Art der VTE sowie potenzieller Auslöser zur Erkennung hormonassoziierter und unprovozierter Ereignisse zu erfragen sind)
- bekannte Thrombophilieparameter in der Familie.
Mit diesen Angaben kann eine erste Orientierung über das generelle VTE-Risiko vorgenommen werden (3). Dafür werden in der S3-Leitlinie unterschiedliche Risikokonstellationen dargestellt und unter Berücksichtigung des VTE-Risikos Empfehlungen für den Umgang mit hormoneller Kontrazeption gegeben. So sollte ein Verzicht auf hormonelle Kontrazeption erwogen werden, bei:
- BMI > 35 kg/m2;
- Raucherinnen;
- gleichzeitigem Vorliegen von zwei Risikofaktoren aus Alter > 35 Jahre, BMI > 35 kg/m2 oder Rauchen;
- positiver Eigenanamnese für VTE.
Die unterschiedlichen VTE-Risiken der einzelnen hormonellen Kontrazeptiva müssen bei der Verordnung berücksichtigt werden. Dabei sind insbesondere Kontrazeptiva mit niedrigerem VTE-Risiko vorzuziehen (6). Ein wesentlicher Punkt ist die Aufklärung der Patientin über mögliche Anzeichen und Symptome einer venösen bzw. arteriellen Thromboembolie.
Als behördlich beauflagtes Schulungsmaterial stehen derzeit eine aktuelle Checkliste für die Verschreibung hormoneller Kontrazeptiva sowie eine Informationskarte für die Patientinnen zur Verfügung.
Fazit für die Praxis
2021 wurden zwei neue Kontrazeptiva vermarktet und als besonders gut verträglich und vorteilhaft beworben. Bei beiden – der DRSP-only-Pille und der Kombinationspille mit dem neuartigen Estrogen Estetrol/DRSP – sind derzeit die beworbenen „Vorteile“ nicht abschließend zu bewerten bzw. zu bestätigen.
Das mit dem Einsatz hormoneller KOK verbundene VTE-Risiko ist wesentlich von der Art des verwendeten Gestagens abhängig. Die unterschiedlichen VTE-Risiken der einzelnen hormonellen Kontrazeptiva müssen bei der Verordnung berücksichtigt werden. Dabei sind insbesondere Kontrazeptiva mit niedrigerem VTE-Risiko vorzuziehen. DRSP bedingt in KOK mit Ethinylestradiol ein höheres Risiko für VTE als Kombinationspräparate mit Gestagenen der zweiten Generation wie Levonorgestestrel und Norethisteron. Um das VTE-Risiko für DRSP als Monopräparat und als KOK mit Estetrol zu evaluieren, und insbesondere dieses im Vergleich zu anderen hormonellen Kontrazeptiva einzuordnen, fehlen derzeit Langzeitdaten bzw. Daten aus der breiteren Anwendung unter „Alltagsbedingungen“ außerhalb von Studien. Die Patientinnen müssen bei einer Verordnung darüber aufgeklärt werden.
Literatur
- Eymers E, Römer T. Orale Kontrazeptiva: Wie neugewonnene Evidenz zu einer Veränderung der Arzneimitteltherapie führt. In: Schröder H, Thürmann PA, Telschow C, Schröder M, Busse R (Hrsg.): Arzneimittel-Kompass 2022. Qualität der Arzneimittelversorgung. Berlin: Springer Open. S. 127–37.
- Kondom löst Pille als Verhütungsmethode ab. Deutsches Ärteblatt online; 16.11.2023. Verfügbar unter: www.aerzteblatt.de/nachrichten/147406/Kondom-loest-Pille-als-Verhuetungsmethode-ab.
- Wiegratz I, Thaler CJ. Hormonal contraception – what kind, when, and for whom? Dtsch Arztebl Int 2011; 108(28-29):495–505. doi: 10.3238/arztebl.2011.0495.
- Hormonelle Empfängnisverhütung. S3-Leitlinie der DGGG, SGGG und OEGGG. AWMF-Registernummer 015/015; Version 1.2; September 2020. Verfügbar unter: register.awmf.org/de/leitlinien/detail/015-015.
- European Medicines Agency. Assessment report for combined hormonal contraceptives containing medicinalproducts. EMA/739865/2013; 21.11.2013. Verfügbar unter: www.ema.europa.eu/documents/variation-report/evra-h-c-410-a31-1356-epar-assessment-report-article-31_en.pdf.
- Bundesinstitut für Arzneimittel und Medizinprodukte. Venöse Thromboembolien und kombinierte hormonale Kontrazeptiva. 23.4.2024. Verfügbar unter: www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/Themendossiers/Kombinierte-hormonale-Kontrazeptiva/KOK.html.
- Schink T, Princk C, Haug U. Risiko venöser Thromboembolien bei Einnahme von kombinierten hormonalen Kontrazeptiva. Bulletin zur Arzneimittelsicherheit 2021; (2): 13–6.
- RIVET – Retrospective Cohort Study on the Risk of Venous Thromboembolism (RIVET-RCS). [Stand: 8.7.2024]. Verfügbar unter: ctv.veeva.com/study/rivet-retrospective-cohort-study-on-the-risk-of-venous-thromboembolism.
- Rote-Hand-Brief zu kombinierten hormonalen Kontrazeptiva mit Chlormadinonacetat/Ethinylestradiol: Leicht erhöhtes Risiko für venöse Thromboembolien; 23.2.2024. Verfügbar unter: www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2024/rhb-chlormadinon-estradiol.html.
- Schink T, Princk C, Braitmaier M, Haug U. Use of combined oral contraceptives and risk of venous thromboembolism in young women: a nested case-control analysis using German claims data. BJOG 2022; 129(13):2107–16. doi: 10.1111/1471-0528.17268.
- van Hylckama Vlieg A, Helmerhorst FM, Rosendaal FR. The risk of deep venous thrombosis associated with injectable depot-medroxyprogesterone acetate contraceptives or a levonorgestrel intrauterine device. Arterioscler Thromb Vasc Biol 2010;30(11):2297-300. doi: 10.1161/ATVBAHA.110.211482.
- AIDA und YASMINELLE – Jenapharm und Schering verstoßen gezielt gegen das Heilmittelwerbegesetz; arznei-telegramm 2006; 37:93.
- Lifestyle-Kontrazeptivum Petibelle/Yasmin – Zurückhaltung angebracht. blitz-a-t; 21.11. 2000.
- Dicheva S. „Antibabypille”. In: Glaeske G, Schicktanz C (Hrsg.). BARMER GEK-Arzneimittelreport 2011. St. Augustin: Asgard-Verlag. S. 89-112.
- Yasmin kostete Bayer bereits über zwei Milliarden Dollar. Deutsche Apotheker Zeitung; 16.3.2016. Verfügbar unter: www.deutsche-apotheker-zeitung.de/news/artikel/2016/03/16/yasmin-kostet-bayer-bereits-uber-zwei-milliarden-dollar.
- Römer T, Bitzer J, Egarter C, Hadji P, Kiechle M, Kramer H et al. Stellenwert und Zukunft oraler Gestagen-Monopräparate. Beilage in Frauenarzt 2021; 62. Verfügbar unter: www.exeltis.de/file/show/359/0e8b76/Beilage%20in%20FRAUENARZT%208%202021.pdf.
- Exeltis. Pharma-Trend Innovation Award kürt Slinda® zum „Innovativsten Produkt 2021“. Estrogenfreie Drospirenon-Pille hebt die orale Konzentration auf ein neues Level. Verfügbar unter: www.exeltis.de/produkte/verhuetung/slinda.
- Läkemedelsverket – Swedish Medical Products Agency (2019): Public Assessment Report, Scientific discussion: Slinda (drospirenone). SE/H/1809/01/DC; 26.6.2019. Verfügbar unter: docetp.mpa.se/LMF/Slinda%20Film-coated%20tablet%20ENG%20sPAR_09001bee80a2a66e.pdf.
- Palacios S, Colli E, Regidor PA. Bleeding profile of women using a drospirenone-only pill 4 mg over nine cycles in comparison with desogestrel 0.075 mg. PLoS One. 2020 Jun 29;15(6):e0231856. doi: 10.1371/journal.pone.0231856.
- Regidor PA, Colli E, Palacios S. Overall and bleeding-related discontinuation rates of a new oral contraceptive containing 4 mg drospirenone only in a 24/4 regimen and comparison to 0.075 mg desogestrel. Gynecol Endocrinol 2021; 37(12):1121–7. doi: 10.1080/09513590.2021.1963432.
- Europäische Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen; [Stand: 26.10.2024]. Verfügbar unter: www.adrreports.eu/de/index.html.
- Exeltis Germany GmbH. Fachinformation „Slinda 4 mg Filmtabletten“; Juni 2023.
- Kolatorova L, Vitku J, Suchopar J, Hill M, Parizek A. Progesterone: A Steroid with Wide Range of Effects in Physiology as Well as Human Medicine. Int J Mol Sci 2022 Jul 20;23(14):7989. doi: 10.3390/ijms23147989.
- Gérard C, Foidart JM. Estetrol: From Preclinical to Clinical Pharmacology and Advances in the Understanding of the Molecular Mechanism of Action. Drugs R D. 2023; 23(2):77-92. doi: 10.1007/s40268-023-00419-5.
- Westphal, K. Verhüten mit der Pille? Aber natürlich! Gynäkologie + Geburtshilfe 2021; 26(5): 77.
- Weber N. Neue Verhütungspille mit unklarem Thromboserisiko. Spiegel Gesundheit; 16.6.2021. Verfügbar unter: www.spiegel.de/gesundheit/diagnose/angebliche-zaubersubstanz-in-kombipraeparat-drovelis-neue-verhuetungspille-mit-unklarem-thrombose-risiko-a-d357c06f-a611-476a-81e7-d1fedbe0b838.
- Hebel B. FaktenSchmied präsentiert: Die Werbeanzeigen des Monats Juni 21; 1.7.2024. Verfügbar unter: www.faktenschmied.de/blog/die-werbeanzeigen-des-monats-juni-21.
- Gemzell-Danielsson K, Apter D, Zatik J, Weyers S, Piltonen T, Suturina L et al. Estetrol-Drospirenone combination oral contraceptive: a clinical study of contraceptive efficacy, bleeding pattern and safety in Europe and Russia. BJOG 2022; 129(1):63-71. doi: 10.1111/1471-0528.16840.
- Creinin MD, Westhoff CL, Bouchard C, Chen MJ, Jensen JT, Kaunitz AM et al. Estetrol-drospirenone combination oral contraceptive: North American phase 3 efficacy and safety results. Contraception 2021;104(3):222–8. doi: 10.1016/j.contraception.2021.05.002.
- European Medicines Agency. European Public Assessment Report (EPAR): Drovelis® (Estetrol / Drospirenone) – Assessment Report. Procedure No. EMEA/H/C/005336/0000; Amsterdam, 21.3.2021. Verfügbar unter: www.ema.europa.eu/en/medicines/human/EPAR/drovelis.
- Gedeon Richter Plc. Fachinformation „Drovelis 3 mg/14,2 mg Filmtabletten“; März 2023.
Interessenkonflikte
Die Autorinnen geben an, keine Interessenkonflikte zu haben.