Cholesterinsenkung bei Carotisplaques – Wo ist die Evidenz?
Rubrik: Therapie aktuell
Der Deutschlandfunk sendete am 2. Januar 2024 ein Interview mit Herrn Prof. Stephan Baldus zur kardiovaskulären Prävention („Herzinfarkt vorbeugen“, abrufbar unter: https://www.deutschlandfunk.de/herzinfarkt-vorbeugen-gespraech-mit-stephan-baldus-dlf-0d312aaf-100.html). Prof. Baldus ist Direktor der Medizinischen Klinik III und des Herzzentrums des Kölner Universitätsklinikums. Im zweiten Teil der Sendung beantwortete er Hörerfragen zu kardiovaskulären Erkrankungen. Unter anderem empfahl Prof. Baldus einem Hörer mit einer geringen, einseitigen Carotisplaque eine „sehr strenge“ Einstellung des Cholesterins (Minute 25:30). Dies entspricht den Empfehlungen der ESC(European Society of Cardiology)-Leitlinie (1). Aus Sicht der ESC gehören Personen mit asymptomatischen, in der Bildgebung festgestellten Carotisplaques zur gleichen Risikokategorie wie Patienten mit klinisch manifesten Erkrankungen, beispielsweise nach einem Myokardinfarkt („very high risk“). Die ESC-Leitlinie empfiehlt für diese Patientengruppe eine LDL-C-Senkung um mindestens 50 % und auf < 70 mg/dl. Eine weitere Therapieintensivierung (LDL-C-Zielwert < 55 mg/dl) soll in Abhängigkeit von dem kardiovaskulären Risiko des Patienten und seinen Komorbiditäten erfolgen. Zur Einschätzung des kardiovaskulären Risikos kann laut ESC-Leitlinie der SMART(Secondary Manifestations of Arterial Disease)-Score herangezogen werden. Im Folgenden soll die Evidenz für eine medikamentöse Cholesterinsenkung bei Patienten mit asymptomatischen Carotisplaques ohne klinisch manifeste kardiovaskuläre Erkrankung dargestellt werden.
Begriffsklärung: Intima-Media-Dicke, Carotisplaques, Carotisstenose
Die Dicke der inneren Gefäßwandschichten (Intima und Media) nimmt mit steigendem Lebensalter zu. Die Intima-Media-Dicke (intima-media-thickness, IMT) der Carotiden kann bei einer Ultraschalluntersuchung im B-Bild ausgemessen werden. In Kohortenstudien lag die IMT bei Menschen unter 65 Jahren überwiegend bei ≤ 0,8 mm (Frauen) bzw. ≤ 0,9 mm (Männer) (2). Es existieren derzeit keine allgemein anerkannten geschlechts- und altersspezifischen Normwerte der IMT. Auch die ESC empfiehlt keine Klassifikation des kardiovaskulären Risikos anhand der IMT.
Als Carotisplaque wird eine umschriebene atherosklerotische Veränderung der Gefäßwand der Carotisarterie bezeichnet. Das Consensus-Papier der European Stroke Conference von 2012 (3) definiert „Plaque“ als eine fokale Struktur, die entweder mindestens 0,5 mm bzw. um mehr als 50 % der umgebenden IMT in das Gefäßlumen hineinragt oder die eine IMT über 1,5 mm aufweist.
Nicht jede Carotisplaque führt zu einer Carotisstenose, d. h. zu einer hämodynamisch relevanten Einengung des Gefäßlumens. Die Diagnose einer Carotisstenose sollte deshalb in der Ultraschalluntersuchung nicht allein anhand des B-Bildes gestellt werden. Als Goldstandard für die Graduierung einer Carotisstenose gilt die Farbduplexsonographie (FKDS), mit der hämodynamische Parameter wie beispielsweise eine lokale Strömungsbeschleunigung gemessen werden können (4).
Randomisierte kontrollierte Studien (RCT) zu Statinen bei Carotisplaques: Studiendesign und Patientencharakteristika
Im Jahr 2023 erschien ein systematischer Review der Cochrane Collaboration mit dem Titel „Pharmakologische Interventionen bei asymptomatischer Karotisstenose“ (5). Abweichend von dem Titel des Reviews wurde eine weit gefasste Suchstrategie verfolgt, die nicht nur RCT zu Patienten mit Carotisstenose einschloss, sondern auch RCT zu Patienten mit jeglichen atherosklerotischen Veränderungen der Carotiden. Es kann deshalb davon ausgegangen werden, dass der Cochrane-Review alle RCT erfasst hat, die Statine bei Patienten mit Carotisplaques untersuchten.
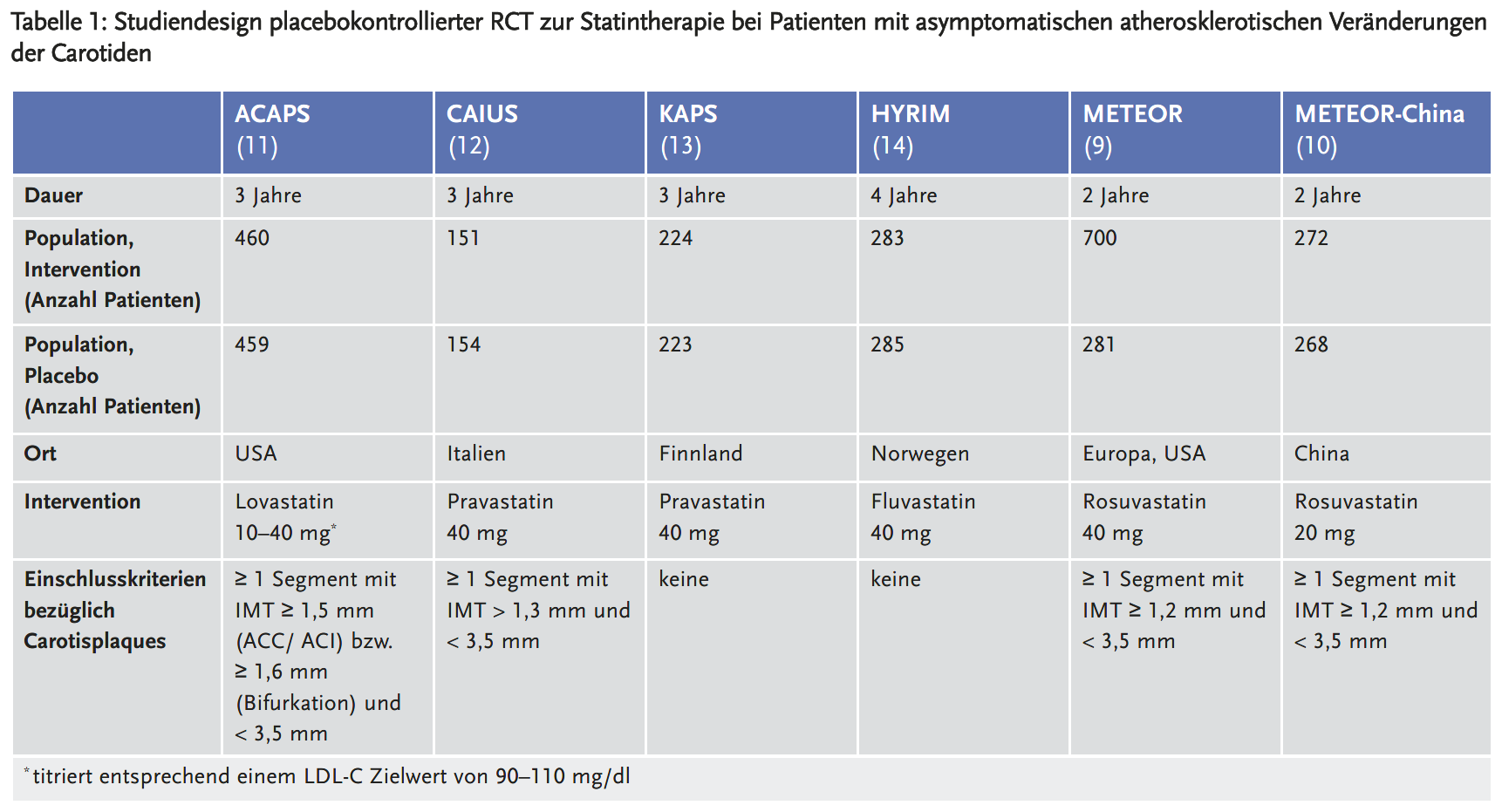
Tabelle 1 gibt einen Überblick über die sechs für die Primärprävention relevanten, placebokontrollierten RCT (< 10 % der Studienteilnehmer mit manifester kardiovaskulärer Erkrankung). Die beiden METEOR-Studien (9, 10) untersuchten ein hochdosiertes Statin (Rosuvastatin 40 mg bzw. 20 mg) über zwei Jahre, die anderen Studien untersuchten niedrig bis moderat dosierte Statine (Fluvastatin 40 mg, Lovastatin 10–40 mg, Pravastatin 40 mg) über drei bis vier Jahre. Mit Ausnahme der Studie METEOR-China (10) wurden alle RCT in Europa oder den USA durchgeführt.
Das Durchschnittsalter der untersuchten Patienten lag bei knapp 60 Jahren. Die Studien KAPS (13) und HYRIM (14) schlossen ausschließlich männliche Patienten ein, in den übrigen RCT war das Geschlechterverhältnis weitgehend ausgewogen. Der durchschnittliche LDL-C-Wert war zu Studienbeginn mit 137 mg/dl am niedrigsten in der Studie METEOR-China (10), in drei RCT lag er zwischen 150 und 160 mg/dl (9, 11, 14) und in zwei RCT zwischen 180 und 190 mg/dl (12, 13). Nur die Studie ACAPS (11) forderte als Einschlusskriterium das Vorhandensein von Carotisplaques entsprechend der heute gängigen Definition, nämlich mindestens eine IMT-Messung ≥ 1,5 mm. Aufgrund der Baseline-Charakteristika ist anzunehmen, dass die Studie CAIUS (12) überwiegend Patienten mit Carotisplaques einschloss (maximale IMT-Messung zu Studienbeginn im Durchschnitt 1,9 mm). Die übrigen Studien geben nur den Durchschnitt aller IMT-Messungen an. Dieser lag zwischen 1,1 mm in der Studie METEOR-China (10) und 1,7 mm in der Studie KAPS (13). Die Werte sind nicht direkt miteinander vergleichbar, da sich die IMT-Messungen in den verschiedenen Studien unterscheiden, beispielsweise hinsichtlich der Anzahl der Messungen und ihrer genauen Lokalisation. In den Studien KAPS (13) und HYRIM (14) wurden wahrscheinlich überwiegend Patienten mit Carotisplaques untersucht (IMT-Durchschnittswerte von 1,7 mm bzw. 1,6 mm), in den Studien METEOR (9) und METEOR-China (10) war ihr Anteil vermutlich geringer (IMT-Durchschnittswerte von 1,2 mm bzw. 1,1 mm).
Placebokontrollierte RCT zu Statinen bei Carotisplaques: Ergebnisse zu kardiovaskulären Ereignissen
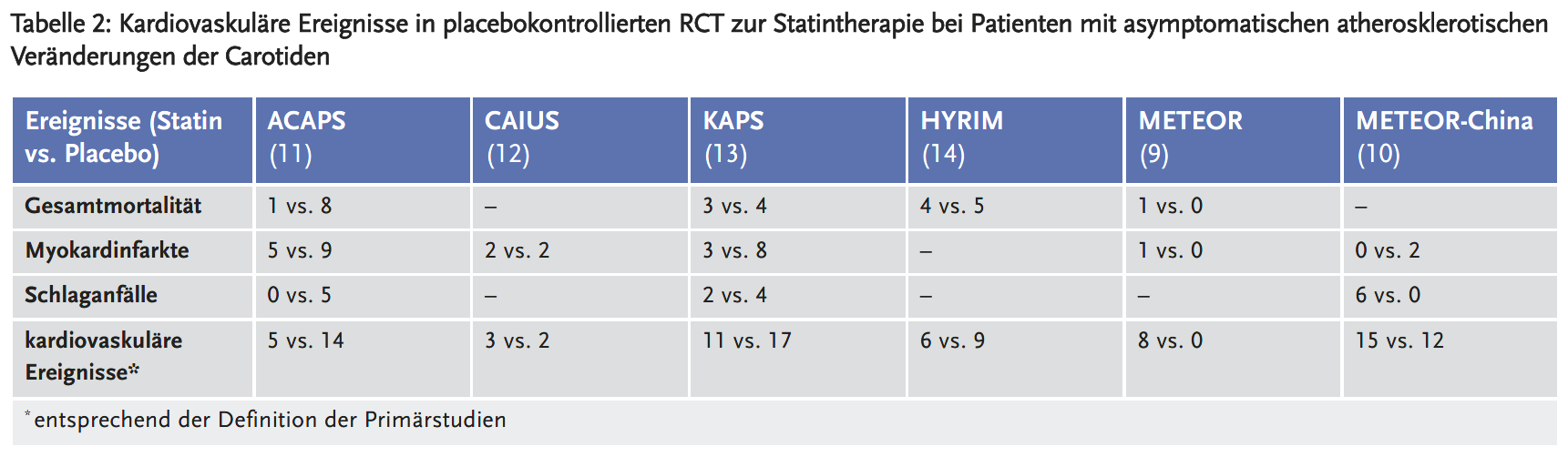
Die vorliegenden RCT waren nicht dafür ausgelegt, kardiovaskuläre Ereignisse zu beurteilen. Es traten nur wenige Myokardinfarkte, Schlaganfälle und Todesfälle auf (siehe Tabelle 2). Alle Studien machten Angaben zum kombinierten Endpunkt „kardiovaskuläre Ereignisse“, definierten diesen jedoch unterschiedlich. Die hohe Fallzahl kardiovaskulärer Ereignisse in der Studie METEOR-China (10) erklärt sich durch die Berücksichtigung von chronischen kardiovaskulären Veränderungen (z. B. koronare Atherosklerose, zerebrale Stenose) und Symptomen (z. B. Angina pectoris).
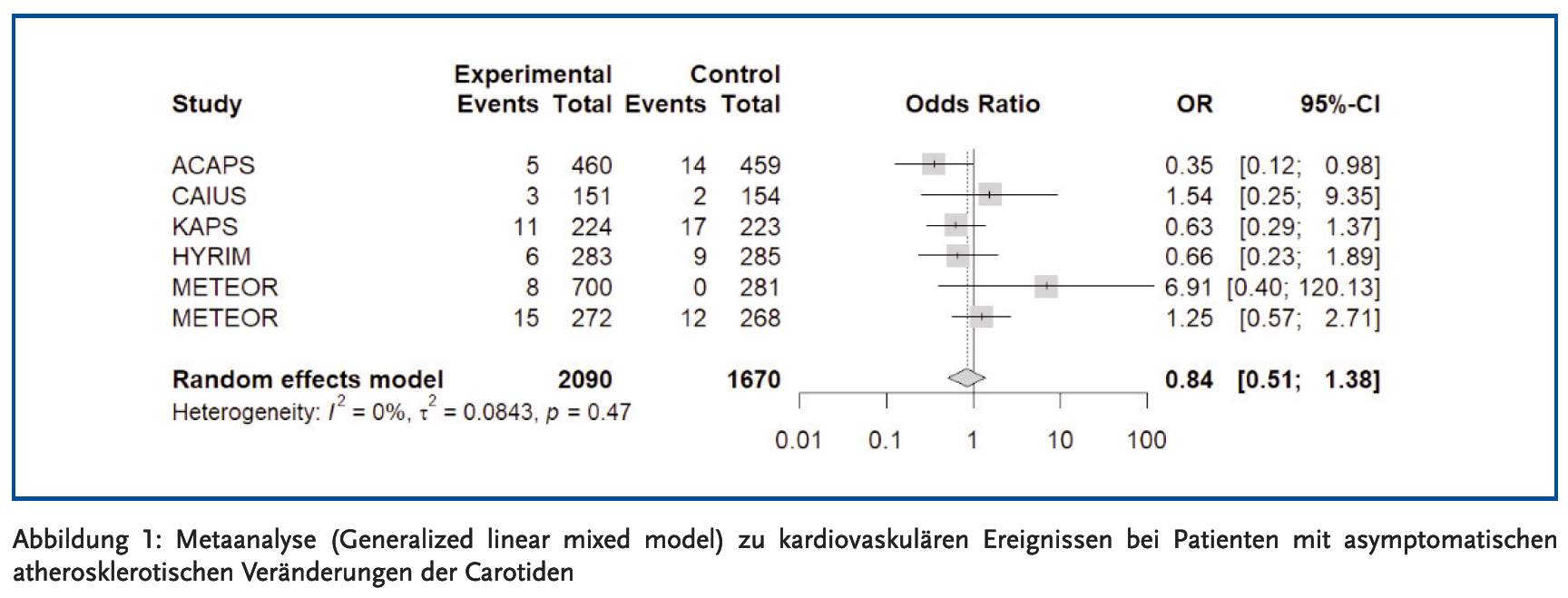
Insgesamt traten in den sechs RCT im Statin-Arm 48 und im Placebo-Arm 54 kardiovaskuläre Ereignisse auf, entsprechend einer Ereignisrate von 2,3 % vs. 3,2 %. Die Metaanalyse (Abbildung 1) zeigt eine Odds Ratio von 0,84. Aufgrund der geringen Ereigniszahl entsprechen sich OR und relatives Risiko (RR) weitgehend. Statine führten somit im Vergleich zu Placebo zu einer relativen Risikoreduktion (RRR) für kardiovaskuläre Ereignisse von etwa 16 %. Dieser Effekt ist geringer als in anderen primärpräventiven Studien: Ein umfassender Review der USPSTF (United States Preventive Services Taskforce) (15) von 2022 ergab eine RRR von 28 % durch Statine bei Patienten ohne manifeste kardiovaskuläre Erkrankung (22 RCTs, n = 90624). Die Analysen der CTT(Cholesterol Treatment Trialists)-Collaboration haben eine weitgehend konstante RRR durch Statine über verschiedene Patientenpopulationen der Primär- und Sekundärprävention hinweg gezeigt (16). Die niedrigere RRR in den vorliegenden Studien erscheint deshalb am ehesten zufallsbedingt: Die 95 %-Konfidenzintervalle deuten auf starke statistische Unsicherheit hin und schließen auch die 1 (d. h. kein statistisch signifikanter Unterschied zwischen den Gruppen) mit ein.
Für die Behandlungsentscheidung ist wichtig, wie stark sich das absolute Risiko eines Patienten durch die Intervention verändert. Das Ausmaß der absoluten Risikoreduktion (ARR) wird vom kardiovaskulären Ausgangsrisiko beeinflusst: Je höher das Risiko eines Patienten für ein kardiovaskuläres Ereignis ist, desto größer ist die zu erwartende ARR und damit der Nutzen der Intervention. In Metaanalysen der CTT-Collaboration lag die kardiovaskuläre Ereignisrate in der Kontrollgruppe bei durchschnittlich 1,8 % pro Jahr, wenn keine manifeste kardiovaskuläre Erkrankung vorlag, und bei 5,6 % pro Jahr, wenn eine KHK bekannt war (16). Als kardiovaskuläre Ereignisse galten in der CTT-Analyse nichttödliche Myokardinfarkte, Schlaganfälle, koronare Revaskularisationen und kardiovaskuläre Todesfälle. Die vorliegenden RCT zu Patienten mit asymptomatischer Atherosklerose der Carotiden zeigten in der Kontrollgruppe eine kardiovaskuläre Ereignisrate von 3,2 % über die Studiendauer von 2–4 Jahren. In diese Ereignisrate flossen – im Unterschied zur CTT-Collaboration – auch chronische kardiovaskuläre Veränderungen und Symptome ein. Eine niedrige kardiovaskuläre Ereignisrate bestand auch dann, wenn ausschließlich Patienten mit Carotisplaques nach heute gängiger Definition eingeschlossen wurden (11). Das kardiovaskuläre Ausgangsrisiko dieser Patientengruppe scheint somit geringer zu sein als das Durchschnittsrisiko in der Primärprävention und es liegt deutlich unter dem kardiovaskulären Risiko von Patienten mit bekannter KHK. Entsprechend ist für Patienten mit Carotisplaques ein deutlich geringerer Nutzen der Statintherapie zu erwarten als für Patienten mit manifesten kardiovaskulären Erkrankungen.
Fazit für die Praxis
Sechs RCT verglichen Statine gegen Placebo bei Patienten mit asymptomatischen atherosklerotischen Veränderungen der Carotiden. Die Studien waren nicht dafür ausgelegt, kardiovaskuläre Ereignisse zu untersuchen. Auffallend ist jedoch, dass in allen Studien die kardiovaskuläre Ereignisrate bereits im Placeboarm gering war (3,2 % über 2–4 Jahre). Dies gilt auch für diejenigen RCT, die ausschließlich oder mehrheitlich Patienten mit Carotisplaques einschlossen. Die vorliegende Evidenz rechtfertigt deshalb nicht, Patienten mit Carotisplaques pauschal als „Hochrisikopatienten“ zu klassifizieren und der Sekundärprävention zuzuordnen. Vielmehr erscheint eine individuelle Risikoeinschätzung angebracht. Geeignete Risiko-Algorithmen für die Primärprävention sind beispielsweise arriba (absolute und relative Risikoreduktion: individuelle Beratung in der Allgemeinpraxis) oder SCORE2 (Systematic Coronary Risk Estimation 2), die klassische kardiovaskuläre Risikofaktoren wie Alter, Raucherstatus und Lipidwerte einbeziehen. Wird das kardiovaskuläre Risiko auf dieser Grundlage als hoch eingeschätzt, so profitieren die meisten Patienten von moderat dosierten Statinen. In der Primärprävention ist es nicht belegt, dass eine Hochdosistherapie oder eine Titration nach bestimmten LDL-C-Werten einer moderaten Statindosis überlegen ist (weitere Informationen zur Statintherapie in der Primärprävention siehe (17)).
Literatur
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. European Heart Journal 2021; 42(34):3227–337. doi: 10.1093/eurheartj/ehab484.
- Chambless LE, Heiss G, Folsom AR, Rosamond W, Szklo M, Sharrett AR et al. Association of coronary heart disease incidence with carotid arterial wall thickness and major risk factors: the Atherosclerosis Risk in Communities (ARIC) Study, 1987-1993. Am J Epidemiol 1997; 146(6):483–94. doi: 10.1093/oxfordjournals.aje.a009302.
- Touboul P-J, Hennerici MG, Meairs S, Adams H, Amarenco P, Bornstein N et al. Mannheim carotid intima-media thickness and plaque consensus (2004-2006-2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011. Cerebrovasc Dis 2012; 34(4):290–6. doi: 10.1159/000343145.
- Arning C, Widder B, Reutern GM von, Stiegler H, Görtler M. Ultraschallkriterien zur Graduierung von Stenosen der A. carotis interna - Revision der DEGUM-Kriterien und Transfer in NASCET-Stenosierungsgrade. Ultraschall Med 2010; 31(3):251–7. doi: 10.1055/s-0029-1245336.
- Clezar CN, Flumignan CD, Cassola N, Nakano LC, Trevisani VF, Flumignan RL. Pharmacological interventions for asymptomatic carotid stenosis. Cochrane Database Syst Rev 2023; 8(8):CD013573. doi: 10.1002/14651858.CD013573.pub2.
- Yamada K, Yoshimura S, Kawasaki M, Enomoto Y, Asano T, Minatoguchi S et al. Effects of atorvastatin on carotid atherosclerotic plaques: a randomized trial for quantitative tissue characterization of carotid atherosclerotic plaques with integrated backscatter ultrasound. Cerebrovasc Dis 2009; 28(4):417–24. doi: 10.1159/000235746.
- Zeng X, Zeng Sr X, Li Y, Zeng Y. [P22] Effects of Pravastatin on Carotid Plaques and Preventing Stroke in Patients with Hypercholesterolemia. Stroke 2004:257.
- Sawayama Y, Shimizu C, Maeda N, Tatsukawa M, Kinukawa N, Koyanagi S et al. Effects of probucol and pravastatin on common carotid atherosclerosis in patients with asymptomatic hypercholesterolemia. Fukuoka Atherosclerosis Trial (FAST). J Am Coll Cardiol 2002; 39(4):610–6. doi: 10.1016/s0735-1097(01)01783-1.
- Crouse JR, Raichlen JS, Riley WA, Evans GW, Palmer MK, O'Leary DH et al. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA 2007; 297(12):1344–53. doi: 10.1001/jama.297.12.1344.
- Zheng H, Li H, Wang Y, Li Z, Hu B, Li X et al. Rosuvastatin Slows Progression of Carotid Intima-Media Thickness: The METEOR-China Randomized Controlled Study. Stroke 2022; 53(10):3004–13. doi: 10.1161/STROKEAHA.120.031877.
- Furberg CD, Adams HP, Applegate WB, Byington RP, Espeland MA, Hartwell T et al. Effect of lovastatin on early carotid atherosclerosis and cardiovascular events. Asymptomatic Carotid Artery Progression Study (ACAPS) Research Group. Circulation 1994; 90(4):1679–87. doi: 10.1161/01.cir.90.4.1679.
- Mercuri M, Bond MG, Sirtori CR, Veglia F, Crepaldi G, Feruglio FS et al. Pravastatin reduces carotid intima-media thickness progression in an asymptomatic hypercholesterolemic mediterranean population: the Carotid Atherosclerosis Italian Ultrasound Study. The American Journal of Medicine 1996; 101(6):627–34. doi: 10.1016/s0002-9343(96)00333-6.
- Salonen R, Nyyssönen K, Porkkala E, Rummukainen J, Belder R, Park JS et al. Kuopio Atherosclerosis Prevention Study (KAPS). A population-based primary preventive trial of the effect of LDL lowering on atherosclerotic progression in carotid and femoral arteries. Circulation 1995; 92(7):1758–64. doi: 10.1161/01.cir.92.7.1758.
- Anderssen SA, Hjelstuen AK, Hjermann I, Bjerkan K, Holme I. Fluvastatin and lifestyle modification for reduction of carotid intima-media thickness and left ventricular mass progression in drug-treated hypertensives. Atherosclerosis 2005; 178(2):387–97. doi: 10.1016/j.atherosclerosis.2004.08.033.
- Chou R, Cantor A, Dana T, Wagner J, Ahmed A, Fu R et al. Statin Use for the Primary Prevention of Cardiovascular Disease in Adults: A Systematic Review for the U.S. Preventive Services Task Force [Evidence Synthesis No. 219. AHRQ Publication No. 22-05291-EF-1]. Rockville (MD): Agency for Healthcare Research and Quality; 2022.
- Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376(9753):1670–81. doi: 10.1016/S0140-6736(10)61350-5.
- Arzneimittelkommission der deutschen Ärzteschaft. Leitfaden: Medikamentöse Cholesterinsenkung zur Vorbeugung kardiovaskulärer Ereignisse. 1. Auflage, Version 1.0 (März 2023). Berlin: AkdÄ; 2023. Verfügbar unter: www.akdae.de/arzneimitteltherapie/lf/leitfaden-cholesterinsenkung.
Interessenkonflikte
Die Autorin und die Autoren geben an, keine Interessenkonflikte zu haben.