Alzheimer-Antikörper erhält keine Zulassung – ein patientenorientierter Beschluss der EMA
Rubrik: Arzneimittel – kritisch betrachtet
Der Ausschuss für Humanarzneimittel (CHMP) der EMA hat dem Hype um Amyloid-Antikörper in Teilen der Alzheimer-Szene und dem damit verbundenen öffentlichen Druck standgehalten und im Juli 2024 eine Empfehlung gegen die Zulassung von Lecanemab (Leqembi®) zur Behandlung der Alzheimer-Demenz ausgesprochen (1). Er begründete diese Entscheidung mit Art und Schweregrad der Nebenwirkungen, die den klinischen Nutzen nicht aufwögen. Das ist eine gute Nachricht – vor allem für die Patientensicherheit.
Lecanemab bei Alzheimer-Demenz
Lecanemab ist ein humanisierter Mausantikörper vom Typ Immunglobulin-G1κ, der Protofibrillen erkennt und die Ablagerung von Beta-Amyloid in den betroffenen Hirnarealen verhindert. Wie viele andere therapeutische monoklonale Antikörper (mAb) wird er gentechnisch in Ovarialzellen des Chinesischen Zwerghamsters (CHO-Zellen) hergestellt.
Kritisch sah der CHMP vor allem die Amyloid-assoziierten Bildgebungsanomalien (amyloid-related imaging abnormalities, ARIA) (1). Das ist eine sehr zurückhaltende Beschreibung besorgniserregender Beobachtungen: In der Zulassungsstudie traten bei 17 % der Probanden lokale Hirnschwellungen und Mikroblutungen auf. Auch wenn die meisten Fälle symptomlos verliefen, zeigten einige der davon betroffenen Patienten und Patientinnen einen schwerwiegenden Verlauf. Wegen dieses Risikos müssen innerhalb der ersten 15 Behandlungsmonate alle drei Monate Kontrollen mit MRT erfolgen. Treten Auffälligkeiten im MRT oder auch symptomatische Beschwerden auf, muss die MRT-Kontrolle wöchentlich oder zweiwöchentlich erfolgen (2). Eine immense Belastung für die Patientin bzw. den Patienten – aber auch für die Gesundheitssysteme.
ARIA als unerwünschte Wirkung dieses therapeutischen Prinzips sind nicht neu. Bereits von den beiden anderen gegen Beta-Amyloid gerichteten mAb Aducanumab und Donanemab ist diese möglicherweise invalidisierende oder gar lebensbedrohliche Nebenwirkung bekannt. Aducanumab wurde 2021 von der FDA in einem umstrittenen Verfahren beschleunigt (Accelerated Approval Pathway) zugelassen (3), mit der Auflage eine weitere RCT zum Nachweis des klinischen Nutzens durchzuführen. Im Januar 2024 gab der Zulassungsinhaber bekannt, den Vertrieb von Adacanumab Ende 2024 aufzugeben und das Arzneimittel vom Markt zu nehmen. Gleichzeitig wurde die Phase-IV-Studie ENVISION zu dem Wirkstoff vorzeitig beendet (4). Donanemab wurde im Juli 2024 im Rahmen einer regulären Zulassung von der FDA zugelassen und befindet sich derzeit in der Prüfung durch die EMA.
Accelerated Approval Pathway
Lecanemab und auch Aducanumab wurden im Rahmen eines beschleunigten Zulassungsverfahrens (Accelerated Approval Pathway) zugelassen. Dieses Verfahren erlaubt der FDA, Arzneimittel für schwerwiegende Erkrankungen zuzulassen, für die ein ungedeckter medizinischer Bedarf (unmet medical need) besteht auf Grundlage klinischer Daten, die lediglich auf Surrogat-Endpunkten beruhen. Im Fall der monoklonalen Antikörper gegen Alzheimer-Demenz war der Surrogatendpunkt die Verringerung der Amyloid-Plaques im Gehirn, die einen klinischen Nutzen für die Patienten voraussagen sollte. Als Auflage zur beschleunigten Zulassung ist eine klinische Studie durchzuführen, die oft als Bestätigungsstudie (confirmatory study) bezeichnet wird, um den erwarteten klinischen Nutzen zu belegen. Auf Basis dieser Daten wird die Zulassung in eine reguläre Zulassung überführt. Dies erfolgte für Lecanemab im Juni 2023 auf Basis der finalen Ergebnisse der randomisierten, kontrollierten Phase-III-Studie CLARITY AD (5).
Die Alzheimer Demenz ist ohne Zweifel eine schwerwiegende Erkrankung, für die es bis dato keine wirksame Behandlung gibt und für die daher ein therapeutischer Durchbruch sehnsüchtig erwartet wird. Die gegen Beta-Amyloid gerichteten Strategien wecken schon seit vielen Jahren große Erwartungen, da das therapeutische Prinzip grundsätzlich plausibel ist. Nachweislich lösen diese mAb Beta-Amyloid-Plaques auf, die bei Alzheimer Nervenfasern im Gehirn ummanteln und so für die kognitiven Einschränkungen der Alzheimer-Demenz verantwortlich sein sollen. Besäße nun einer der neuen Wirkstoffe auch eine patientenrelevante Effektivität, dürfte über die Vertretbarkeit der genannten Nebenwirkungen diskutiert werden.
Leider aber gehen die konstatierten patientenrelevanten Benefits über einen sehr geringen Effekt nicht hinaus. Dies wurde kürzlich in einem hervorragenden Kommentar von Espay et al. (6) anschaulich herausgearbeitet.
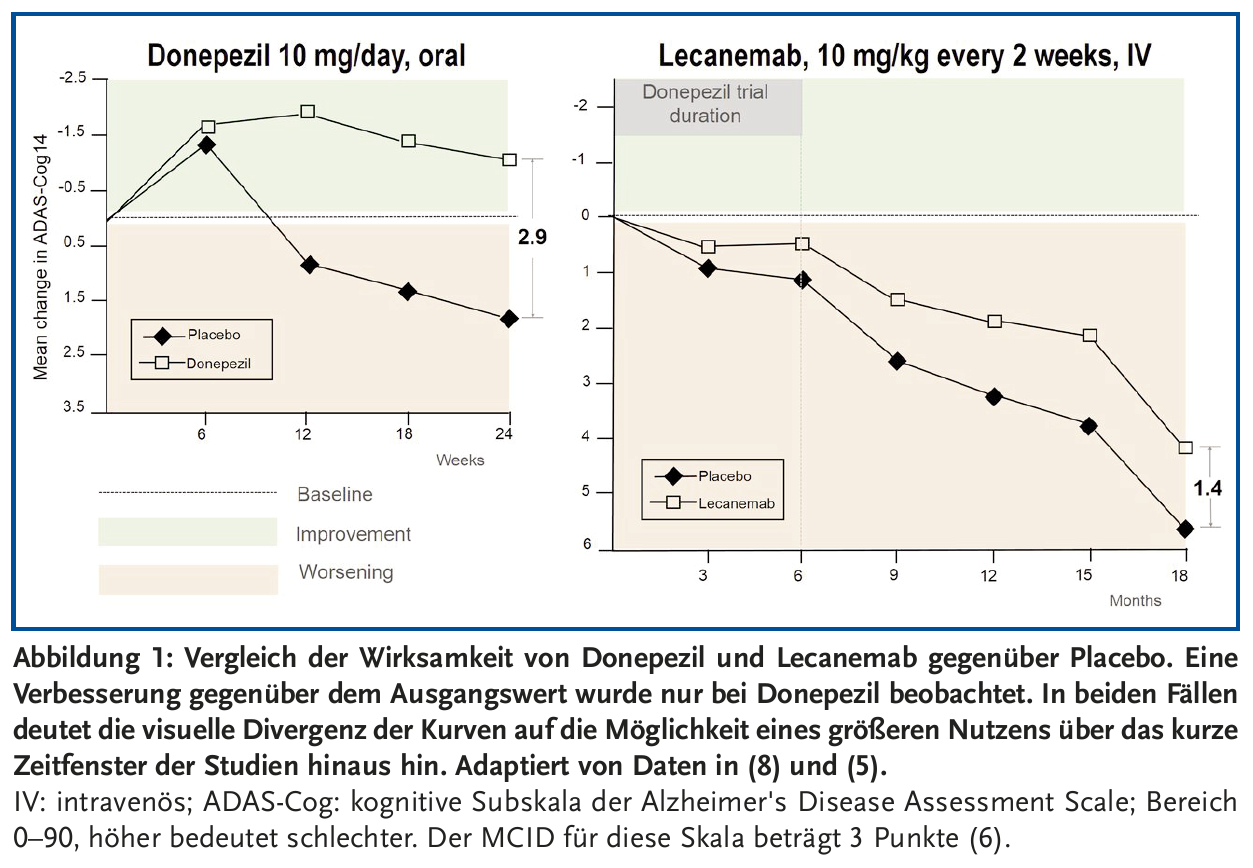
Für die klinische Verbesserung durch Lecanemab (Abbildung 1) wird eine Verringerung in der Clinical Dementia Rating Scale Sum of Boxes (CDR-SB) angeführt, ein 18-Punkte-Score für die Bewertung der kognitiven Funktionen. Der durchschnittliche Baseline-Score von 3,2, entsprechend einer milden kognitiven Beeinträchtigung, verschlechterte sich innerhalb von 18 Monaten auf 4,86 unter Placebo und auf 4,41 unter Lecanemab (5).
Somit beträgt der absolute Unterschied 0,45 Punkte entsprechend einer relativen Reduktion von 27 %. Hier setzt die erste Kritik an: Dieser Unterschied ist weniger als die Hälfte dessen, was typischerweise von den Patienten als klinischer Effekt bemerkt werden kann (7). Umso fraglicher wird die klinische Relevanz der Effekte von Lecanemab, wenn man einen indirekten Vergleich mit Studien zu dem Acetylcholinesterase-Inhibitor Donepezil anstellt, in denen meist der verbreitete ADAS-Cog (Alzheimer Disease Assessment Score – cognitive subscale) zur Bewertung herangezogen wurde. Die Verbesserung unter Donepezil im Vergleich zu Placebo beträgt durchschnittlich etwa 2,9 Punkte (8), während Lecanemab es im Placebovergleich auf 1,4 Punkte bringt, also auf knapp die Hälfte des Donepezil-Effektes (5).
Nach einem Cochrane Review sind selbst die Verbesserungen in den neurologischen Scores durch Donepezil nicht von einem relevanten Benefit bezüglich des klinischen Outcome und der Lebensqualität begleitet (9), was eine klinische Relevanz des Effektes von Lecanemab auf die neurologischen Scores fast schon ausschließen lässt.
Fazit
Man kann dem CHMP bescheinigen, dass er seine Empfehlung gegen die Marktzulassung von Lecanemab mit sorgfältigem und differenziertem Blick auf die für die Patienten und Patientinnen relevanten Vor- und Nachteile ausgesprochen hat. Dies sieht sogar die Deutsche Alzheimergesellschaft so (10). Es bleibt zu hoffen, dass der CHMP auch bei der Bewertung von Donanemab dieselben Kriterien zugrunde legen und der Patientensicherheit oberste Priorität einräumen wird.
Literatur
- European Medicines Agency, Committee for Medicinal Products for Human Use. Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 22-25 July 2024. Amsterdam, 26.7.2024. Verfügbar unter: www.ema.europa.eu/en/news/meeting-highlights-committee-medicinal-products-human-use-chmp-22-25-july-2024.
- Eisai Inc. Leqembi® (lecanemab-irmb) injection: Full prescribing information; Juli 2023. Verfügbar unter: www.accessdata.fda.gov/drugsatfda_docs/label/2023/761269Orig1s001lbl.pdf.
- Food and Drug Administration. Aducanumab (marketed as Aduhelm) Information; Silver Spring, 8.7.2021. Verfügbar unter: www.fda.gov/drugs/postmarket-drug-safety-information-patients-and-providers/aducanumab-marketed-aduhelm-information.
- Meglio M. Biogen Walks Away From Aducanumab to Prioritize Lecanemab and Alzheimer Disease Pipeline; NeurologyLive, 31.01.2024. Verfügbar unter: www.neurologylive.com/view/biogen-walks-away-from-aducanumab-prioritize-lecanemab-alzheimer-disease-pipeline.
- van Dyck CH, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M et al. Lecanemab in Early Alzheimer's Disease. N Engl J Med 2023; 388(1):9–21. doi: 10.1056/NEJMoa2212948.
- Espay AJ, Kepp KP, Herrup K. Lecanemab and Donanemab as Therapies for Alzheimer's Disease: An Illustrated Perspective on the Data. eNeuro 2024; 11(7). doi: 10.1523/ENEURO.0319-23.2024.
- Lansdall CJ, McDougall F, Butler LM, Delmar P, Pross N, Qin S et al. Establishing Clinically Meaningful Change on Outcome Assessments Frequently Used in Trials of Mild Cognitive Impairment Due to Alzheimer's Disease. J Prev Alzheimers Dis 2023; 10(1):9–18. doi: 10.14283/jpad.2022.102.
- Rogers SL, Farlow MR, Doody RS, Mohs R, Friedhoff LT. A 24-week, double-blind, placebo-controlled trial of donepezil in patients with Alzheimer's disease. Donepezil Study Group. Neurology 1998; 50(1):136–45. doi: 10.1212/wnl.50.1.136.
- Birks JS, Harvey RJ. Donepezil for dementia due to Alzheimer's disease. Cochrane Database Syst Rev 2018; 6(6):CD001190. doi: 10.1002/14651858.CD001190.pub3.
- Deutsche Alzheimer Gesellschaft. Alzheimer Medikament Leqembi nicht zugelassen: Deutsche Alzheimer Gesellschaft zur Entscheidung der Europäischen Arzneimittel-Agentur (EMA); Berlin, 30.7.2024. Verfügbar unter: www.deutsche-alzheimer.de/artikel/alzheimer-medikament-leqembi-nicht-zugelassen-deutsche-alzheimer-gesellschaft-zur-entscheidung-der-europaeischen-arzneimittel-agentur-ema.
Interessenkonflikte
Der Autor gibt an, keine Interessenkonflikte zu haben.