Erenumab (Aimovig®)
(frühe Nutzenbewertung, neue wissenschaftliche Erkenntnisse)
In Kürze
- Erenumab ist seit 2018 zur Migräneprophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat zugelassen (1).
- Bei Markteinführung empfahl die AkdÄ den Einsatz von Erenumab nur nach Versagen aller anderen Wirkstoffe zur Migräneprophylaxe oder bei deren Unverträglichkeit, da Langzeitdaten fehlen (2).
- Bei der frühen Nutzenbewertung von Erenumab ergab sich für das IQWiG und die AkdÄ in der Gesamtschau ein Hinweis auf einen nicht quantifizierbaren Zusatznutzen (IQWiG: mindestens beträchtlich) für Patienten mit mindestens vier Migränetagen pro Monat, für die eine konventionelle Migräneprophylaxe infrage kommt, gegenüber der ZVT Best Supportive Care (BSC) (Fragestellung 3). Für die Fragestellungen 2 und 3 wurden vom pharmazeutischen Unternehmer (pU) keine relevanten Daten vorgelegt (3;4).
- Der G-BA sah für Erenumab in dieser Fragestellung einen Anhaltspunkt für einen beträchtlichen Zusatznutzen als belegt an (5;6).
- Bei der vorliegenden Bewertung handelt es sich um die erneute Nutzenbewertung von Erenumab aufgrund eines Antrages des pU wegen neuer wissenschaftlicher Erkenntnisse.
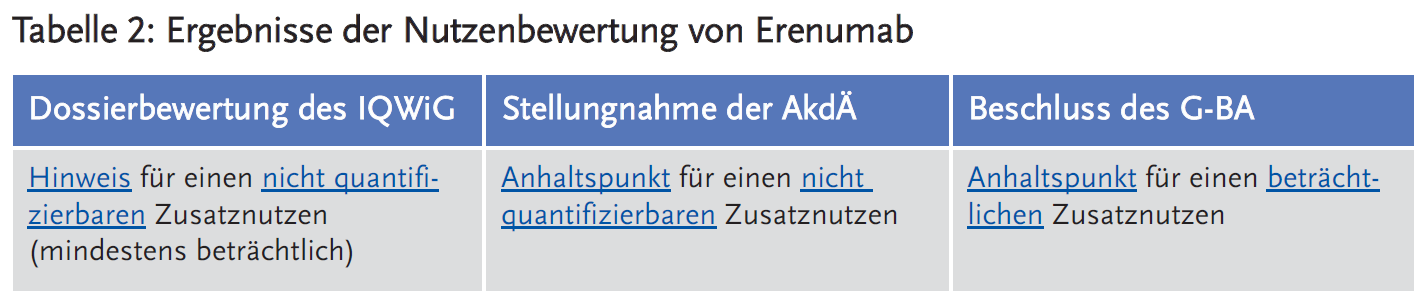
- Das IQWiG und die AkdÄ sehen anhand der neu vorgelegten Ergebnisse (Studie HER-MES) (7) für Erenumab in dieser Fragestellung lediglich einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen, das IQWiG stuft diesen als mindestens beträchtlich ein (8;9). Die AkdÄ weist in ihrer Stellungnahme auf methodische Verzerrungspotenziale in der Studie HER-MES hin. Erenumab führt zwar zu einer erhöhten Therapieadhärenz, es wurde jedoch mit Topiramat unter den Migräneprophylaktika der Komparator mit dem höchsten Potenzial für Nebenwirkungen gewählt. Die höchste in einer Run-in-Phase ermittelte Startdosis durfte bei Zeichen der Unverträglichkeit nicht reduziert werden, der Studienabbruch wurde als Endpunktereignis gewertet. Die Behandlung im Erenumab-Arm begann mit der halben maximal zugelassenen Tagesdosierung und konnte je nach Ansprechen gesteigert werden. Für Topiramat wurde angestrebt, dass die Patienten durch das Auftitrieren – wöchentliche Erhöhung um 25 mg bis zur höchsten verträglichen Dosis – die Dosis von 100 mg erreichen. Das Auftreten von Nebenwirkungen unter Topiramat wurde als Endpunktereignis Studienabbruch gewertet. Darüber hinaus ist grundsätzlich zu bemängeln, dass vor Studieneinschluss der Patienten nicht alle Behandlungsalternativen ausgeschöpft worden waren.
- Der G-BA sieht in seinem Beschluss einen Anhaltspunkt für einen beträchtlichen Zusatznutzen von Erenumab gegenüber der ZVT Topiramat. Zusammenfassend zeigen sich für den G-BA anhand der vorgelegten Daten in den Endpunktkategorien Morbidität für die Endpunkte zu „Migränetagen pro Monat“ sowie in der gesundheitsbezogenen Lebensqualität statistisch signifikante Vorteile für Erenumab gegenüber Topiramat, die im Ausmaß als beträchtlich gewertet werden. In der Kategorie der Nebenwirkungen sieht der G-BA für Erenumab gegenüber der ZVT Topiramat beim Endpunkt Abbruch wegen UE einen statistisch signifikanten, beträchtlichen Vorteil zugunsten von Erenumab gegenüber Topiramat (10).
Bei der aktuellen Bewertung handelt es sich um die erneute Nutzenbewertung des Arzneimittels Erenumab aufgrund eines Antrages des pU wegen neuer wissenschaftlicher Erkenntnisse.
Erenumab ist zugelassen zur Migräneprophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat (1). Die vorliegende Bewertung bezieht sich auf die Patientenpopulation: „Erwachsene mit mindestens vier Migränetagen pro Monat, für die eine konventionelle Migräneprophylaxe infrage kommt.“ Als zweckmäßige Vergleichstherapie wurden vom G-BA die Wirkstoffe Metoprolol, Propranolol, Flunarizin, Topiramat, Amitriptylin oder Clostridium botulinum Toxin Typ A bestimmt (siehe Tabelle 1); der pU wählte Topiramat.

Für die Neubewertung legte der pU die Ergebnisse der randomisierten kontrollierten Studie HER-MES vor, in der Erenumab mit Topiramat verglichen wird. Insgesamt wurden in der Studie 777 Patienten randomisiert im Verhältnis 1:1 einer Behandlung entweder mit Erenumab (N = 389) oder mit Topiramat (N = 388) zugeteilt. Die Patienten erhielten die höchste individuell verträgliche Dosis Erenumab (70 mg oder 140 mg alle vier Wochen über 24 Wochen) oder Topiramat (50 mg bis 100 mg Topiramat nach einer sechswöchigen Titrationsphase über 18 Wochen). Topiramat sollte laut Studienprotokoll auf 100 mg aufdosiert werden. Nur wenn dies „aus Sicherheitsgründen als unmöglich eingeschätzt wurde“, konnte eine niedrigere Erhaltungsphase gewählt werden. Im Gegensatz zu dieser restriktiven Zieldosierung von Topiramat konnte in der Studie im Erenumab-Arm bei unzureichendem Ansprechen die Dosis von 70 mg auf 140 mg gesteigert werden, eine fixe Zieldosis wurde nicht vorgegeben. Eine Reduktion der Erhaltungsdosis war in beiden Armen nicht gestattet. Aufgrund der zu erwartenden schlechteren Verträglichkeit von Topiramat in einer Dosierung von 100 mg (nach der bisherigen Studienlage) beinhaltet dieses Design die Gefahr eines Bias zugunsten von Erenumab.
In der klinischen Praxis wird bei Unverträglichkeit eines Wirkstoffs in der Migräneprophylaxe auf einen anderen Wirkstoff gewechselt. In der HER-MES-Studie war nach Abbruch der Studienmedikation jedoch kein Wechsel auf eine andere Migräneprophylaxe erlaubt.
Primärer Endpunkt war der Therapieabbruch wegen unerwünschter Ereignisse (UE). Sekundäre Endpunkte waren die Gesamtmortalität und verschiedene Morbiditätskategorien, gesundheitsbezogene Lebensqualität und Nebenwirkungen.
Therapieabbrüche wegen UE traten bei 10,6 % im Erenumab-Arm und bei 38,9 % im Topiramat-Arm auf. Der Unterschied ist klinisch relevant. Allerdings war der Topiramat-Arm durch das Studiendesign eindeutig benachteiligt (siehe oben). Es wird bezweifelt, ob die Abbruchrate von 38,9 % im Studienarm Topiramat der Versorgungsrealität in Deutschland entspricht.
Eine Reduktion der Migränetage um ≥ 50 % über die letzten drei Monate sowie über den ersten Monat erreichten signifikant mehr Patienten unter Erenumab als unter Topiramat (215 [55,4 %] vs. 121 [31,2 %] bzw. 147 [37,9 %] vs. 86 [22,2 %]; jeweils p < 0,001). Für den Endpunkt „gesundheitsbezogene Lebensqualität“ zeigt sich für die Verbesserung um ≥ 5 Punkte im SF-36 sowohl für den körperlichen als auch für den physischen Summenscore jeweils ein statistisch signifikanter Vorteil für Erenumab gegenüber Topiramat. Für die Responderanalyse zur 15-%-Skalenspannbreite (Verbesserung um ≥ 9,4 Punkte im SF-36 PCS bzw. Verbesserung um ≥ 9,4 Punkte im SF-36 MCS) zeigt sich hingegen kein statistisch signifikanter Unterschied. Auch hinsichtlich schwerwiegender UE gab es keinen Unterschied zwischen den beiden Wirkstoffen. Spezifische Nebenwirkungen wie Erkrankungen des Nervensystems (z. B. Parästhesie, Aufmerksamkeitsstörung, Schwindelgefühl) sowie Übelkeit, Ermüdung und verminderter Appetit waren unter Topiramat häufiger. Todesfälle traten in keiner Gruppe auf (7;9).
Dossierbewertung IQWiG:
- In der Gesamtschau ergeben sich für das IQWiG mehrere positive und ein negativer Effekt. Bei den positiven Effekten gibt es für schwerwiegende/schwere Symptome/Folgekomplikationen Hinweise auf einen erheblichen bzw. beträchtlichen Zusatznutzen von Erenumab im Vergleich zu Topiramat. Zudem zeigen sich bei den nicht schwerwiegenden/nicht schweren Nebenwirkungen in mehreren Endpunkten (u. a. Abbruch wegen UE, spezifische UE „Erkrankungen des Nervensystems“) Hinweise auf einen geringeren Schaden, mehrheitlich mit dem Ausmaß beträchtlich. Demgegenüber zeigt sich ein negativer Effekt mit dem Ausmaß beträchtlich bei dem Endpunkt spezifische UE „Obstipation“. Unklar bleibt für das IQWiG, ob und inwieweit die nicht erlaubte Dosisreduktion von Topiramat die UE und die Abbruchraten in der Studie beeinflusst hat. Neben den genannten Endpunkten ist auch bei den anderen Endpunkten unklar, wie groß der Einfluss auf die entsprechenden Effekte von Erenumab im Vergleich zur ZVT wäre, wenn die Patienten, die die Therapie abbrachen, eine Folgetherapie erhalten hätten. Aufgrund dieser Einschränkungen kann nach Auffassung des IQWiG der Zusatznutzen nicht quantifiziert werden. Da jedoch nicht davon ausgegangen wird, dass die großen Effekte bei einzelnen UE (insbesondere Parästhesien) durch Dosisreduktionen massiv verringert würden, ist dieser nicht quantifizierbare Zusatznutzen mindestens beträchtlich (8).
Stellungnahme der AkdÄ:
- Prinzipiell sah die AkdÄ die vom G-BA für die Nutzenbewertung als zweckmäßige Vergleichstherapie (ZVT) definierten Wirkstoffe (siehe Tabelle 1) als adäquat an. Sie entsprechen aktuellen Therapiestandards und Leitlinien.
- Allerdings wird üblicherweise der für den Patienten geeignete Wirkstoff entsprechend den individuell erwarteten Nebenwirkungen verordnet. Eine Vergleichstherapie, die die klinische Praxis abbildet, müsste somit alle vom G-BA als ZVT vorgeschlagenen Wirkstoffe einschließen.
- In der Fachinformation von Topiramat wird explizit darauf hingewiesen, dass Patienten auch von niedrigeren Tagesdosierungen als 100 mg profitieren können (11).
- Zudem wird in der klinischen Praxis bei Unverträglichkeit eines Wirkstoffs in der Migräneprophylaxe üblicherweise auf einen anderen Wirkstoff gewechselt. In der HER-MES-Studie war nach Abbruch der Studienmedikation kein Wechsel auf eine andere Migräneprophylaxe erlaubt (3;4). Die Abbruchrate wegen Nebenwirkungen lag im Topiramat-Arm deutlich höher (38,9 %) als im Erenumab-Arm (10,6 %), der Abbruch unter Topiramat erfolgte vorwiegend in den ersten sechs Wochen (8). Dies führte dazu, dass im Topiramat-Arm ein höherer Anteil der Patienten in der Erhaltungsphase unbehandelt war als im Erenumab-Arm (8). Aus den dargelegten Gründen entsprach somit die ZVT nicht der „Best Clinical Practice“.
- In Bezug auf den Schaden ergab sich insgesamt ein günstiges Nebenwirkungsprofil für Erenumab. Statistisch signifikante Unterschiede zum Vorteil von Erenumab zeigen sich im primären Endpunkt, den Therapieabbrüchen aufgrund von UE (siehe oben). Für die spezifischen UE wie Symptome am Nervensystem einschließlich Parästhesien, Aufmerksamkeitsstörungen und Schwindelattacken sowie Übelkeit, Ermüdung und Appetitlosigkeit zeigte sich ein signifikanter Unterschied zum Vorteil von Erenumab im Vergleich zu Topiramat. Sie traten unter Topiramat (65,2 %) deutlich häufiger auf als unter Erenumab (24,7 %). Dieser Unterschied ist klinisch relevant. Allerdings ist aufgrund der nicht erlaubten Dosisreduktion bei Unverträglichkeit eine Verzerrung zuungunsten von Topiramat nicht auszuschließen. Anders als vom IQWiG angenommen, sind die UE von Topiramat am Nervensystem oft dosisabhängig (12). Zudem hatte die AkdÄ in ihrer Stellungnahme darauf hingewiesen, dass durch die bei den mit Topiramat behandelten Migränepatienten häufig induzierten Parästhesien die Verblindung beeinträchtigt sein könnte. Für den Endpunkt Obstipation zeigte sich ein signifikanter Unterschied zum Nachteil von Erenumab.
- Insgesamt schloss sich die AkdÄ der Bewertung des IQWIG an und sah trotz der beschriebenen Unsicherheiten einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen. Die bisherige Adhärenz bei Migräneprophylaktika ist bisher gering, die meisten Patienten setzen ihre Medikation bereits in den ersten sechs Monaten ab (13;14), Therapieabbrüche sind in den meisten Fällen auf Nebenwirkungen zurückzuführen. Betrachtet man den Wirkmechanismus von Erenumab und zusätzlich die bisher vorliegenden klinischen Studien STRIVE (15) (erste Phase-III-Studie), ARISE (16) (zweite Phase-III-Studie) sowie LIBERTY (17) (prospektive Analyse), zeigt sich in der Gesamtschau, dass sich das Nebenwirkungsprofil von Erenumab positiv auf die Therapieadhärenz auswirken könnte. Dies deuten auch trotz der oben beschriebenen methodischen Mängel die Ergebnisse aus der Studie HER-MES an (7).
Beschluss des G-BA:
- Für den G-BA zeigen sich in den Endpunktkategorien Morbidität für die Endpunkte „Migränetage pro Monat“ sowie in der gesundheitsbezogenen Lebensqualität zu Woche 24 sowohl im generischen SF-36, als auch im HIT-6 statistisch signifikante Vorteile für Erenumab gegenüber Topiramat, die vom G-BA im Ausmaß als beträchtlich gewertet wurden. In der Kategorie der Nebenwirkungen liegen für Erenumab gegenüber der ZVT Topiramat statistisch signifikante Vorteile zu Woche 24 vor. Für den Endpunkt Abbruch wegen UEs zeigt sich ein statistisch signifikanter, beträchtlicher Vorteil zugunsten von Erenumab gegenüber Topiramat, bei der Gesamtrate der SUE sind keine Vor- oder Nachteile ableitbar.
- Der G-BA beschloss auf der Grundlage dieser Ergebnisse, dass für Erenumab gegenüber der ZVT Topiramat ein Anhaltspunkt für einen beträchtlichen Zusatznutzen vorliegt (10).
Literatur
- Novartis Pharma GmbH: Fachinformation "Aimovig® 70 mg Injektionslösung in einer Fertigspritze/Injektionslösung im Fertigpen". Stand: Mai 2021.
- Arzneimittelkommission der deutschen Ärzteschaft: Erenumab (Aimovig®). Arzneiverordnung in der Praxis (AVP) 2019; 46: 75-80.
- Arzneimittelkommission der deutschen Ärzteschaft: Stellungnahme zu Erenumab (Migräne), Nr. 717, Auftrag A18-71, Version 1.0, Stand: 30. Januar 2019: www.akdae.de/fileadmin/user_upload/akdae/Stellungnahmen/AMNOG/A-Z/Erenumab/Erenumab-EB.pdf. Letzter Zugriff: 24. Januar 2022.
- IQWiG-Berichte – Nr. 717: Erenumab (Migräne) – Nutzenbewertung gemäß § 35a SGB V, Auftrag: A18-71, Version: 1.0, Stand: 30.01.2019: https://www.iqwig.de/download/A18-71_Erenumab_Nutzenbewertung-35a-SGB-V_V1-0.pdf. Letzter Zugriff: 24. Januar 2022.
- Gemeinsamer Bundesausschuss: Beschluss über eine Änderung der Arzneimittel-Richtlinie (AMRL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Erenumab; 2. Mai 2019: https://www.g-ba.de/downloads/39-261-3770/2019-05-02_AM-RL-XII_Erenumab_D-407_BAnz.pdf. Letzter Zugriff: 24. Januar 2022.
- Gemeinsamer Bundesausschuss: Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Erenumab; 2. Mai 2019: https://www.g-ba.de/downloads/40-268-5716/2019-05-02_AM-RL-XII_Erenumab_D-407_TrG.pdf. Letzter Zugriff: 24. Januar 2022.
- https://clinicaltrials.gov/ct2/show/NCT03828539 (Head-to-head Study of Erenumab Against Topiramate in Patients With Episodic and Chronic Migraine (HER-MES)). Letzter Zugriff: 24. Januar 2022.
- IQWiG-Berichte – Nr. 1161: Erenumab (Migräne) (neue wissenschaftliche Erkenntnisse) – Nutzenbewertung gemäß § 35a SGB V, Auftrag A21-58, Version 1.0, Stand: 28. Juli 2021: https://www.iqwig.de/download/a21-58_erenumab_nutzenbewertung-35a-sgb-v_v1-0.pdf. Letzter Zugriff 24. Januar 2022.
- Arzneimittelkommission der deutschen Ärzteschaft: Stellungnahme zu Erenumab (Migräne), (neue wissenschaftliche Erkenntnisse), Nr. 1161, Auftrag A21-58, Version 1.0, Stand: 28. Juli 2021: www.akdae.de/fileadmin/user_upload/akdae/Stellungnahmen/AMNOG/A-Z/Erenumab/Erenumab-NB.pdf. Letzter Zugriff: 24. Januar 2022.
- Gemeinsamer Bundesausschuss: Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Erenumab (Neubewertung aufgrund neuer wissenschaftlicher Erkenntnisse); 21. Oktober 2021: https://www.g-ba.de/downloads/40-268-7950/2021-10-21_AM-RL-XII_Erenumab_D-669_TrG.pdf. Letzter Zugriff: 24. Januar 2022.
- Janssen-Cilag GmbH: Fachinformation "Topamax® 25 mg/50 mg/100 mg/200 mg Filmtabletten". Stand: Dezember 2020.
- Food and drug administration (FDA): Highlights of prescribing information - Topamax® (Topiramate): https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/020505s063,020844s054lbl.pdf (letzter Zugriff: 24. Januar 2022). Stand: Juni 2021.
- Dozza AL, Krymchantowski AV: Adherence to migraine treatment does not depend on the number of prescribed medications. Arq Neuropsiquiatr 2013; 71: 171-173.
- Berger A, Bloudek LM, Varon SF, Oster G: Adherence with migraine prophylaxis in clinical practice. Pain Pract 2012; 12: 541-549.
- Goadsby PJ, Reuter U, Hallstrom Y et al.: A controlled trial of erenumab for episodic migraine. N Engl J Med 2017; 377: 2123-2132.
- Dodick DW, Ashina M, Brandes JL et al.: ARISE: A Phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia 2018; 38: 1026-1037.
- Reuter U, Goadsby PJ, Lanteri-Minet M et al.: Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful: a randomised, double-blind, placebo-controlled, phase 3b study. Lancet 2018; 392: 2280-2287.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 8. Februar 2022 vorab online veröffentlicht.
