Intraoperatives Floppy-Iris-Syndrom im Zusammenhang mit Tamsulosin („UAW-News International“)
Deutsches Ärzteblatt, Jg. 117, Heft 37, 11.09.2020
Deutsches Ärzteblatt, Jg. 117, Heft 37, 11.09.2020
Das intraoperative Floppy-Iris-Syndrom (IFIS) kann als eine mögliche Komplikation der Kataraktchirurgie auftreten und wurde erstmals 2005 beschrieben (1). Es ist charakterisiert durch die Trias einer „undulierenden“ Iris, Irisvorfall sowie intraoperativer progredienter Miosis (siehe Kasten 1) (1–3). Bei nicht selektierten Patienten wird die Häufigkeit von unter 2 bis über 12 % angegeben (2–7).
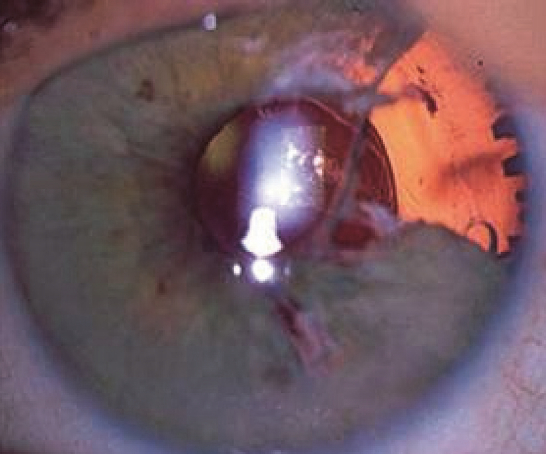
Unter Katarakt („grauer Star“) versteht man eine Linsentrübung, die Auswirkungen auf das Sehvermögen hat (8). Die Prävalenz steigt mit dem Alter und beträgt bei über 80-Jährigen über 90 % (9). Weltweit ist die Katarakt die häufigste Ursache für Erblindung, was in Ländern mit Verfügbarkeit der Kataraktchirurgie wie Deutschland selten eintritt (9;10). Katarakt-Operationen gehören weltweit zu den häufigsten Operationen und zu den kosteneffektivsten Maßnahmen im Gesundheitswesen (3;9). In Deutschland werden jährlich etwa 900.000 Katarakt-Operationen durchgeführt (11). Bei der häufig durchgeführten Phakoemulsifikation wird die getrübte Linse nach minimaler Inzision durch Ultraschall zerkleinert und dann abgesaugt, bevor eine Kunstlinse eingesetzt wird. Die Phakoemulsifikation gilt grundsätzlich als sicher und effektiv (9). Das IFIS kann allerdings Komplikationen wie Irisverletzung, entrundete Pupille und damit mangelnde Blende (Blendempfindlichkeit und schlechteres Nahsehen), hintere Kapselruptur, Netzhautablösung sowie Verlust von Linsenteilen in den Glaskörperraum begünstigen und ein schlechteres Operationsergebnis mit Beeinträchtigung des Sehvermögens zur Folge haben (siehe Abbildung 1) (2;3;12–14).
Abbildung 1: Defekt nach IFIS (mit freundlicher Genehmigung von PD Dr. Andrea Hassenstein, Universitätsklinikum Hamburg-Eppendorf)
Bereits bei der Erstbeschreibung von IFIS wurde auf eine Assoziation mit einer gleichzeitigen oder vorangegangenen Einnahme des Alpha-1-Rezeptorantagonisten (ARA) Tamsulosin hingewiesen (1). Seither wurde die Assoziation insbesondere mit Tamsulosin, aber auch mit anderen ARA wie Alfuzosin oder Doxazosin, immer wieder bestätigt (2–4;6;13–18). ARA werden häufig angewendet zur symptomatischen Behandlung des benignen Prostatasyndroms, von welchem – wie von der Katarakt – vor allem Ältere betroffen sind: Bis zu 80 % der über 80-Jährigen weisen Symptome des unteren Harntrakts (lower urinaray tract symptoms, LUTS) im Zusammenhang mit einer benignen Prostatahyperplasie (BPH) auf (19–21). In Deutschland werden zulasten der GKV am häufigsten Tamsulosin (356 Millionen definierte Tagesdosen [defined daily doses, DDD] in 2018) und Alfuzosin (32 Millionen DDD) verordnet (21). Tamsulosin weist eine höhere Affinität und Selektivität zum α1A-Adrenozeptor auf als die anderen ARA. Über diesen Rezeptor wird jedoch nicht nur der Tonus der glatten Muskulatur der Harnwege kontrolliert, sondern auch der M. dilatator pupillae. Eine unvollständige Kontraktion des M. dilatator pupillae durch Blockade des α1A-Adrenozeptors kann eine unzureichende Erweiterung der Pupille zur Folge haben. Andere ARA besitzen eine geringere Spezifität gegenüber den einzelnen α1-Adrenozeptoren, was zu vermehrter Hypotension führen kann (13). Möglicherweise aufgrund dieser Selektivität für α1A-Adrenozeptoren besitzt Tamsulosin ein höheres IFIS-Risiko: Gegenüber Alfuzosin wird ein bis zu 40-fach erhöhtes Risiko beschrieben (5;15;17). Für die Praxis ist wichtig, dass Tamsulosin anatomische Veränderungen – möglicherweise eine Atrophie des M. dilatator pupillae – zu bewirken scheint, die sich auch nach Absetzen nicht vollständig zurückbilden (3;5;12;13;18).
Zwar sind überwiegend Männer von IFIS betroffen, was auf die Anwendung von ARA zur Behandlung von LUTS bei BPH zurückgeführt wird. IFIS kann jedoch auch bei Frauen (z. B. nach Off-label-Anwendung von Tamsulosin bei rezidivierenden Nierenkoliken (22)) auftreten, und dann eine höhere Komplikationsrate aufweisen als bei Männern (5;13). Neben der Assoziation mit Tamsulosin und anderen ARA werden weitere Risikofaktoren wie Alter, Hypertonie sowie die Anwendung von Finasterid, Angiotensin-2-Rezeptor-Inhibitoren, Benzodiazepinen und verschiedenen Antipsychotika diskutiert (4;6;13;17).
Ärzte, die Tamsulosin und andere ARA verordnen, sollten sich des IFIS-Risikos bewusst sein und Patienten darüber aufklären, auch bei Anwendung in nicht zugelassener Indikation (Off-label-Anwendung). Insbesondere bei Patienten mit klinischen Hinweisen auf eine Katarakt sollte vor Verordnung eines ARA ein Augenarzt einbezogen werden, um die Wahrscheinlichkeit einer zukünftig erforderlich werdenden Katarakt-Operation abzuschätzen (3;13).
Sowohl die Trübung der Augenlinse als auch die BPH kommen mit zunehmendem Alter häufiger vor. Da die Lebenserwartung steigt, wird vermutlich auch die Zahl der Männer mit beiden Erkrankungen zunehmen. Dadurch können zukünftig mehr Männer, die mit einem ARA (insbesondere Tamsulosin) behandelt wurden, bei einer späteren Katarakt-Operation von einem IFIS betroffen sein.
Bei Männern mit LUTS und bereits geplanter Katarakt-Operation sollte der Eingriff möglichst vor Beginn einer Behandlung mit einem ARA durchgeführt werden. Wenn noch keine Katarakt-Operation durchgeführt wurde, sollte – falls ein ARA unverzichtbar erscheint – ein nicht selektiver ARA wie Alfuzosin gewählt werden, für welche das IFIS-Risiko niedriger eingeschätzt wird als für Tamsulosin. Nach erfolgter Katarakt-Operation kann jeder ARA angewendet werden (3;12;13).
Um vor einer geplanten Katarakt-Operation das IFIS-Risiko einschätzen zu können, sollten sowohl Männer als auch Frauen gezielt nach der Anwendung von ARA (auch länger zurückliegend) gefragt werden. Ophthalmologen können dann gegebenenfalls geeignete Maßnahmen ergreifen, um dem IFIS-Risiko zu begegnen (5;13). Wenn Tamsulosin eingenommen wird, sollte es so früh wie möglich vor einer Katarakt-OP abgesetzt werden (3), was nach Kenntnis der AkdÄ bislang jedoch nur selten beachtet wird. Allerdings kann ein IFIS auch durch Absetzen über einen längeren Zeitraum nicht gänzlich vermieden werden (3;12;13).
Bitte teilen Sie der AkdÄ Nebenwirkungen (auch Verdachtsfälle) mit. Sie können online über unsere Website www.akdae.de melden oder unseren Berichtsbogen verwenden, der regelmäßig im Deutschen Ärzteblatt abgedruckt wird.